
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体。下列说法不正确的是
A.CN-中碳元素的化合价为+2
B.该反应的产物之一是无毒的N2
C.当1 molCN-参与反应时,转移3 mol e-
D.处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6L
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下述实验方案能达到实验目的的是
编号 | A | B | C | D |
实验 方案 | |
|
|
|
实验 目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A.该反应的△H> 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D.t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:填空题
(11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
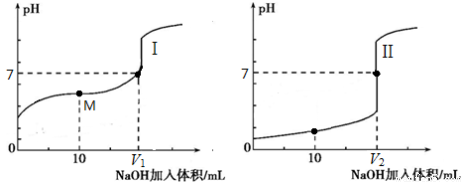
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:填空题
(13分)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
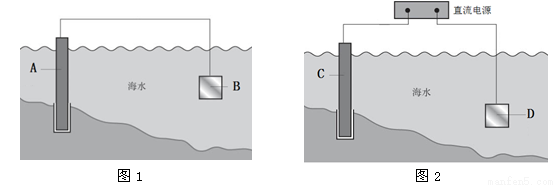
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
(4)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_________________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:推断题
(12分)有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:
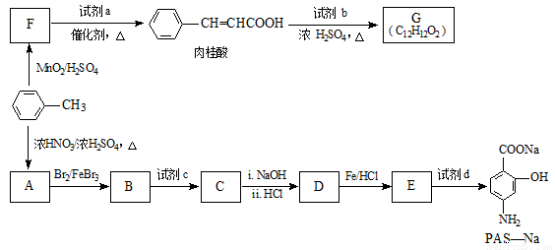
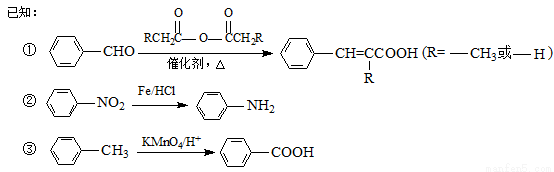
回答下列问题:
(1) 生成A的反应类型是________。
生成A的反应类型是________。
(2)F中含氧官能团的名称是_______;试剂a的结构简式为________。
(3)写出由A生成B的化学方程式:____________。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:_______________。
(5)当试剂d过量时,可以选用的试剂d是______________(填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)写出C与NaOH反应的化学方程式________________。
(7)肉桂酸有多种同分异构体,符合下列条件的有种____________。
a.苯环上有三个取代基;b.能发生银镜反应,且1mol该有机物最多生成4molAg。
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式____(任写一种即可)。
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:实验题
(10分)Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_____________。
(2)吸收塔中的原料B可以选用____________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。

①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是______。装置B的作用是_______。
②C中制备Na2S2O3发生的连续反应有:Na2S +H2O +SO2===Na2SO3 +H2S、_____和__________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:实验题
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.石油是由液态烷烃、烯烃和少量芳香烃组成的混合物
B.40%的甲醇水溶液称成为福尔马林,常用于浸制生物标本
C.乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色
D.油脂、淀粉水解都生成甘油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com