
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
常温下,浓度均为0.1mol·L-1 CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小
B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大
C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+)
D.溶液中由水电离出的C(H+),前者是后者的10m-n倍
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
一种充电电池放电时的电极反应为H2+2OH――2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-
当电池充电时,与外电源正极连接的电极上发生的反应是:
A.H2O的还原 B.NiO(OH)的还原
C.H2的氧化 D.Ni(OH)2的氧化
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
常温下,将100 mL的0.02 mol·L-1的Ba(OH)2溶液和100 mL的0.02 mol·L-1的NaHSO4溶液混合,若忽略溶液体积变化,则混合后的溶液
A.pH=2
B.pH=12
C.由水电离产生的c(H+)=1.0×10-2mol·L-1
D.溶质的物质的量浓度为0.02mol·L-1
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
25 ℃、101 kPa下:①2Na(s)+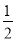 O2(g)===Na2O(s) ΔH1=-414 kJ·mol-1
O2(g)===Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ·mol-1
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ·mol-1
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
A.加MgCl2 B.加H2O C.加NaOH D.加HCl
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法不正确的是:
A.在熔融电解质中,O2-移向负极
B.电池的总反应是:2C4H10+13O2 =8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e- =2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2↑+5H2O
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为:
A.1:9 B.9:1 C.10:1 D.1:10
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
下列关于电解质溶液中离子关系的说法正确的是:
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
常温时,将500 mLpH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法不正确的是
A.若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuO
B.b<a<7
C.阳极电极反应:4OH--4e-===2O2↑+4H+
D.整个过程中是阳极产生氧气,阴极析出铜单质
查看答案和解析>>
科目: 来源:2014-2015甘肃省高二上学期期末化学试卷(解析版) 题型:选择题
在373K 时,把0.5 mol N2O4气体通入体积为5L的密闭容器中发生反应:N2O4(g) 2NO2(g)。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是:
2NO2(g)。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是:
A.平衡时,化学平衡常数K=1.8
B.平衡时,N2O4的转化率为60%
C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
D.在2s时,体系内压强为反应前的1.1倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com