
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系的比较正确的是
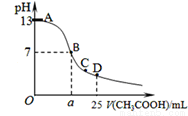
A.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
B.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
D.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是

查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中c(Cu2+)=0.02 mol/L,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
A.2 B.3 C.4 D.5
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
下图中的两条曲线分别表示200℃和300℃时,有反应A(g)+B(g) C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示300℃时的变化曲线的说法正确的是
C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示300℃时的变化曲线的说法正确的是
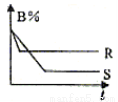
A.△H<0,R曲线 B.△H>0,R曲线
C.△H<0,S曲线 D.△H>0,S曲线
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(14分)回答下列问题
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)____ c(CH3COO-)(“>”、“=”或“<”)。
(2)将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是 。
(3)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)
4C(g)  H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ,若改变条件重新达到平衡后体系中C的质量分数增大,其采取的措施是 。
H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ,若改变条件重新达到平衡后体系中C的质量分数增大,其采取的措施是 。
(4)以丙烷为燃料制作新型燃料电池,电池的一极通入O2和CO2,另一极通入丙烷,电解质是熔融碳酸盐。电池负极的电极反应式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
(5)拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946 kJ,则1mol H2生成NH3的反应热为 。
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(10分)请回答下列问题
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是_______(填字母)。
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
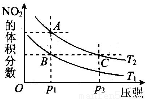
①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(12分)有关硫化物的几个问题。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
②S(s) + O2(g)  SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(14分)Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是____________________。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_____(写出一条即可)。
Cl2(l) ],应采取的措施是_____(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下图甲所示,则Cl2在Pt电极放电的电极反应式是_______。
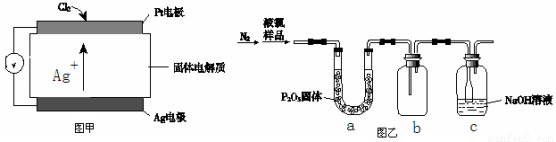
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如上图乙所示:
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
查看答案和解析>>
科目: 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:填空题
(8分)
(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
(2)已知难溶电解质溶解平衡时M(OH)2(s) M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp= 。
M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp= 。
(3)溶液的酸度表示为AG=lg[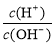 ],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1 AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2= 。
],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1 AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com