
科目: 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 molL-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目: 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。

已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
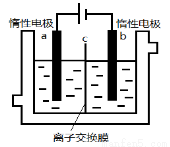
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
查看答案和解析>>
科目: 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
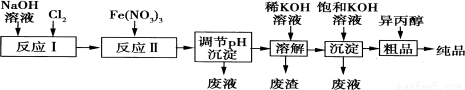
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是
A.塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用
B.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,可做“未来石油”
C.用K2FeO4取代Cl2处理饮用水,可杀菌消毒,但不能沉降水中的悬浮物
D.研发使用高效催化剂,可提高反应中原料的转化率
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A.用湿润的pH试纸测稀碱液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的有机物
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法错误的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A.碳棒上发生的电极反应:4OH—- 4e—= O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷
B.三硝基甲苯的分子式为C7H5N3O6
C.硬脂酸甘油酯和油酸甘油酯互为同系物
D.淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度先减小再增大
B.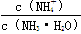 始终增大
始终增大
C.n (CH3COOH)与n (CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,溶液的PH一定为7
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
某溶液中含有的离子是K+、NH4+、Fe2+、Fe3+、A13+、AlO2-、SO42-、CO32-、SiO32-、Cl-、NO3-中的某几种,已知各微粒的浓度均为0.1mol·L-1。现进行如下实验:
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生。
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色。
根据上述实验事实推断,有关该溶液的说法错误的是
A.至少含有4种离子
B.取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀
C.若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+
D.溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com