
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值。下列叙述正确的是:
A.常温常压下,22.4L CH4中含有4NA个C-H键
B.48g O3气体含有3NA个氧原子
C.在1L0 .5mol·L-lFeCl3溶液中含有0.5NA个Fe3+
D.标准状况下,2.24LCCl4含有的分子数为0.1NA
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.Fe3+ 、I-、ClO- 、H+ B.K+、Cu2+、OH-、NO3-
C.NH4+、Na+、Br-、SO42- D.Al3+、Cl-、OH-、HCO3-
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
下列有关原电池和电解池的叙述中,正确的是
A.纯锌与稀硫酸的反应比Zn-Cu合金与稀硫酸的反应更快
B.钢铁发生吸氧腐蚀时,负极的反应式为:Fe-3e-=Fe3+
C.在铁制容器上镀铜时,铁制容器连接外接电源的正极
D.电解精炼铜时,阴极的电极反应为:Cu2+ + 2e-=Cu
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
如图X、Y、A、B、C均为短周期主族元素,下列说法不正确的是
X | A | |
Y | C | B |
A.原子半径大小:Y > C > X > A
B.A、B的氢化物的稳定性:A>B
C.Y、C的最高价氧化物对应水化物的酸性:Y<C
D.B、C简单阴离子的还原性强弱为:B>C
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
下列实验操作和对应的现象、结论都正确的是
选项 | 操 作 | 现 象 | 结 论 |
A | 在滴有酚酞的Na2CO3溶液中加入BaC12溶液 | 红色褪去 | Na2CO3溶液中存在水解平衡 |
B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+ > Cu2+ |
D | 向NaCl溶液滴少量AgNO3溶液,再滴加少量NaI溶液 | 先有白色沉淀,后变成黄色沉淀 | Ksp(AgI) >Ksp(AgCl) |
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
下列溶液中,微粒的物质的量浓度关系正确的是
A.某Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+)
B.常温时,将PH=1的醋酸和PH=13的NaOH溶液等体积混合后的溶液c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
C.NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)=0.2 mol
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
化合物III可通过如下反应制得:

化合物I可通过下列路径合成:

(1)化合物I的分子式为 。化合物Ⅱ中含氧官能团的名称 。
(2)化合物III与NaOH溶液共热反应的方程式为 。
(3)化合物IV的结构简式为 ,生成化合物IV的反应类型为 。
(4)化合物I能发生消去反应,其中一种有机产物的结构简式 。
(5)一定条件下,1 mol化合物Ⅱ和H2反应,最多可消耗H2 mol。
(6)CH3CH2MgBr和 也能发生类似V→VI 的反应,其化学反应方程式 。
也能发生类似V→VI 的反应,其化学反应方程式 。
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
(16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ·mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
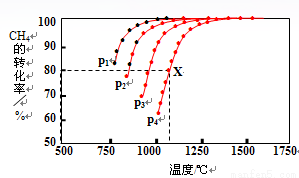
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
A.体系压强不再变化 B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变 D.每消耗1mol H2O(g)的同时生成1mol H2
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K= 。
若此时增大压强,平衡将向 (填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。

查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:简答题
(16分)用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
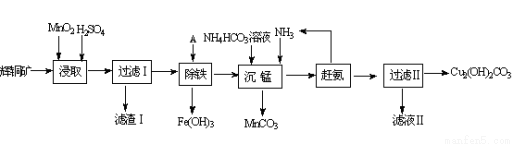
(1)下列措施是为加快浸取速率,无法达到目的的是__ __
A.延长浸取时间 B.将辉铜矿粉碎
C.充分搅拌 D.适当增加硫酸浓度
(2)浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2、S和 (写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是 。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法 。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式____________ ____ _______ ___。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目: 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:实验题
(16分)铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
操作 | 现象 |
| 现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+ 与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为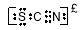 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为____ __极,电极反应式为________________ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com