
科目: 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:实验题
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
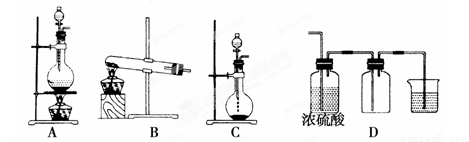
(1)实验室可以用B或C装置制取氨气,如 果用B装置制取氨气其化学反应方程式为 。
果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目 的是____________________。
的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
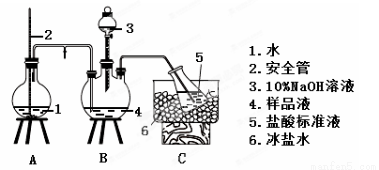
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3分子中所有原子共平面
B.NF3在反应中既做氧化剂又做还原剂
C.生成0.2mol HNO3时转移0.2mol电子
D.氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法中正确的是
A.100mL 1mol·L-1AlCl3溶液中含的阳离子数等于0.1NA
B.标准状况下,22.4L CCl4中含有的CCl4分子数为NA
C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA
D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.PH大于7的溶液:Na+、Ba2+、SO32-、ClO—
B.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
C.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
实验设计是化学实验的重要技能之一。用所给装置(夹持装置省略)完成相关实验,最合理的选项是
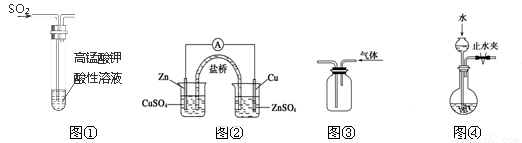
A.图①中KMnO4溶液紫红色褪去,说明SO2具有漂白性
B.图②能构成铜锌原电池
C.图③利用排空气法收集二氧化碳
D.图④检查装置气密性
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
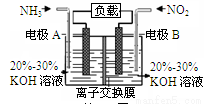
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:

下列说法不正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,升高温度,反应达到新平衡前V(逆)< V (正)
C.反应前2 min的平均速率v (Z)=4.0×10-3mol/(L·min)
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 双原子分子单质在标准状况下密度为1.429g/L |
Z | 单质及其化合物的焰色反应为黄色 |
W | W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的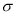 键和
键和 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+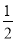 O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
查看答案和解析>>
科目: 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
(16分)ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
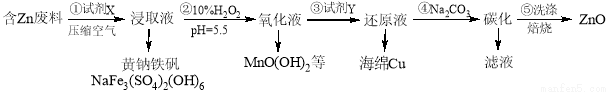
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com