
科目: 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:填空题
(14分)NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a= ,b= 。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。

①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应
速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
下列相关化学知识的说法正确的是
A.分散系中分散质粒子的大小是:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.饱和氯水中含有大量Cl-、NO3-、Na+、SO32-等离子
C.已知K sp(AgCl) >K sp(AgI),由此可以判断AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)能够发生
D.分子数为NA 的C2H4 气体体积约为 22.4 L,其质量为 28 g(N A-阿伏加德罗常数)
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
下列有关实验操作正确的是

A.称量氢氧化钠固体
B.检验铁粉与水蒸气反应产生的氢气
C.配制175 mL 0.10 molL-1盐酸
D.分离两种互溶但沸点相差较大的液体混合物
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
已知弱酸的电离平衡常数如下表:
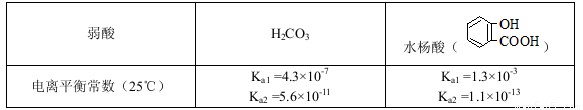
下列选项正确的是
A.常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.
D.水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-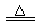 NH3↑+H2O
NH3↑+H2O
C.将过量二氧化硫气体通入氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++NO↑+H2O
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
新一代锂电池的反应为:FePO4+Li LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B.充电时LiFePO4只发生氧化反应不发生还原反应
C.充电过程中,电池正极材料的质量增加
D.加入硫酸可以提高电解质的导电性
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
已知可逆反应温度为T0时,在容积固定的密闭容器中发生X(g)+Y(g) Z(g)(未配平)反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是

A.发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0时,该反应的平衡常数为33.3
D.该反应正反应的反应热ΔH<0
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
25℃时,向10mL0.01mol·L-1KOH溶液中滴加0.01mol·L-1苯酚溶液,混合溶液中粒子浓度关系正确的是
A.当pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.当pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+)
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:填空题
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置 ;E元素价电子排布式为 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是 (写分子式)。
(3)B与D形成的非极性分子的电子式为________。
(4)B、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(1)BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(1)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示): 。
查看答案和解析>>
科目: 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:填空题
原油价格的下跌,加剧能源的过度开采,因此更要开展汽油的有机合成的研究。以下是一种合成汽油的路线:

已知:
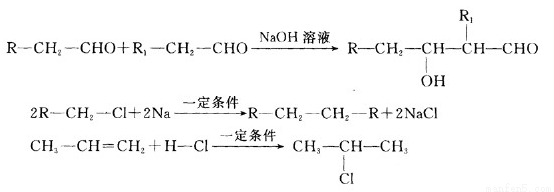
(1)在反应①—⑥中,属于加成反应的是 ,B的分子式为 。
(2)A中官能团名称为 ,CCS法命名E的名称为 。
(3)写出下列反应方程式:
E→F ;
H→G 。
(4)H也能与NaOH溶液反应,其反应方程式为: 。
(5)D的核磁共振氢谱有 组吸收峰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com