
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水 Fe3+ +3H2O Fe(OH)3 +3H+
Fe(OH)3 +3H+
B.用Na2S处理含Hg2+废水 Hg2+ +S2-=HgS↓
C.用Na2CO3溶液处理水垢中的CaSO4 Ca2+ +CO32- =CaCO3↓
D.燃煤时加入石灰石,减少SO2排放 2CaCO3+2SO2 +O2 2CaSO4 +2CO2
2CaSO4 +2CO2
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+ == 2Fe(OH)3 +3 Mg2+
B.草酸使酸性KMnO4溶液褪色:
C.往NaHS04溶液中滴加Ba(OH)2至溶液呈中性:
D.向NaCl0溶液中通人少量的CO2:CO2 +2C1O-+H2O == CO32-+ 2 HC1O已知Ka1(H2 CO3)>Ka( HC1O)>Ka2(H2 CO3)
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
元素代号 | X | W | Y | Z | Q |
原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,一定是共价分子
D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下述实验不能达到预期目的的是
选项 | 实验目的 | 实验方案 |
A | 验证Ksp(AgCl)>Ksp(AgI) | 向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
TESLA电动汽车的电池采用了松下提供的NCA系列(镍钴铝体系)的18650A型钴酸锂(LiCoO2)锂离子电池。电池正极材料为钴酸锂(LiCoO2),负极材料是石墨(C6)。电池反应为: LiCoO2+C6 C6Lix+Li1-xCoO2。下列有关说法不正确的是
C6Lix+Li1-xCoO2。下列有关说法不正确的是
A.锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点
B.废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收
C.放电时,正极锂的化合价未发生改变
D.充电时电池正极上发生的反应为:LiCoO2—x e-=== Li1-x CoO2+xLi+
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
B | 向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在SO32- |
C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2的还原性 |
D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+强 |
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
X | |||
Y | Z |
25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13。
(1)Y的离子结构示意图为 。
(2)X、Z的气态氢化物稳定性较强的是 (填化学式)。
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示)。
(4)工业上,用X单质制取Z单质的化学方程式为 。
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 。(已知25℃,X的最高价氧化物的水化物的电离常数为Kal =4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10)
Ⅱ、碳和氮的化合物与人类生产、生活密切相关。低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 |
平衡常数 | 9.94 | 9 |
请回答下列问题:
(6)上述正反应方向是 反应(填“放热”或“吸热”)。
(7)写出该反应的化学平衡常数表达式:K= 。
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(9)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g)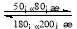 Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,ΔH减小
C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低
D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
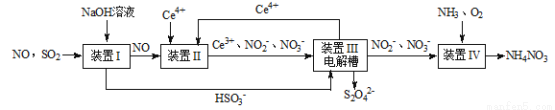
(1)装置Ⅰ中的主要离子方程式为 。
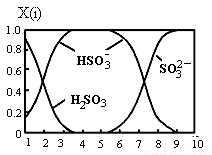 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
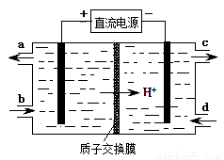
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:实验题
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:实验原理是
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
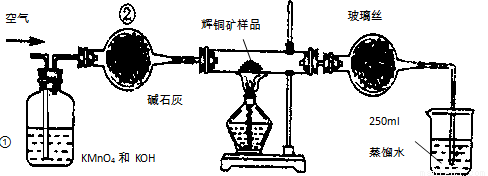
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是__________(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
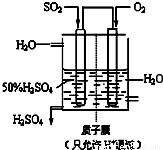
查看答案和解析>>
科目: 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
【化学—物质结构与性质】(13分)
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
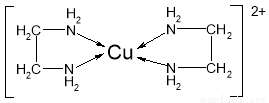
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
A.配位键
B.极性键
C.离子键
D.非极性键
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。
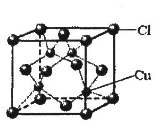
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com