
科目: 来源: 题型:
现代社会中铜在不同领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。

已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为
、 。
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式______________________。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(4)“循环Ⅲ”中反萃取剂的主要成分的化学式是 。
(5)黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O===6Cu+SO2↑。该反应中被氧化的与被还原的元素的质量之比为____________。
查看答案和解析>>
科目: 来源: 题型:
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研
究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在140 ℃左右与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -80 | 135.6 | 遇水生成HCl、SO2、S;300 ℃以上完全分解; S2Cl2+Cl2 |
| SCl2 | -78 | 59 | 略 |
设计实验装置图如右:
(1)右图中装置不够完善在G与H之间缺少 ___________装置。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式___________________________________;
E中反应的化学方程式____________________________________。
(3)C、D中的试剂分别是______________、_____________。
(4)仪器A、B的名称是_______、_______,在实验实施时F导管应较长,其目的是_____。
(5)如果在加热E时温度过高,对实验结果的影响___________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)___________、__________,为了提高S2Cl2的纯度,关键的操作是____________。
查看答案和解析>>
科目: 来源: 题型:
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
 ①同温度下,等pH值的a. NaHCO3 b.NaCN、c.Na2CO3.溶液的物质的量浓度由小到大的顺序为 (填序号)。
①同温度下,等pH值的a. NaHCO3 b.NaCN、c.Na2CO3.溶液的物质的量浓度由小到大的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL
0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3
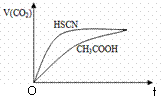
溶液混合,实验测得产生的气体体积(V)随时间(t)的
变化如右图所示:反应初始阶段两种溶液产生CO2气体的
速率存在明显差异的原因是 。
反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是____(填序号)。
 a. c(CH3COO-) b. c(H+)
a. c(CH3COO-) b. c(H+)
c. Kw d. 醋酸电离平衡常数
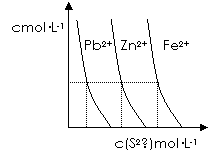
(2)右图为某温度下,PbS(s)、ZnS(s)、FeS(s)分
别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、
金属阳离子浓度变化情况。此温度下,PbS(s)、
ZnS(s)、FeS(s)溶渡积最大的是 ;(填化
学式)如果向三种沉淀中分别滴加同浓度的盐酸,
 最先产生硫化氢气体的是 (填化学式)。
最先产生硫化氢气体的是 (填化学式)。
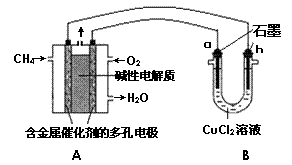
(3)甲烷燃料电池可以提升能量利用率。右图
是利用甲烷燃料电池电解50 mL 2 mol·L-1
的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是
。
②当A中消耗0.1 mol氧气时,B中 极
增重____g
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数均为14.已知甲为原子;乙、丙、丁为双原子分子或离子。
(1)甲的原子结构示意图是 。
(2)乙是双原子分子,在高温时是一种还原剂。14 g乙燃烧放出的热量是141.5 kJ。
写出乙燃烧的热化学方程式 。
(3)丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体,请写出该可燃性气体与氢气1:1加成后的产物发生加聚反应的方程式
。
(4)由丁分子组成的物质属于单质,组成丁的元素的最高价氧化物对应的水化物X有下图所示转化关系(反应条件和其他物质已略)

①已知W为常见金属单质,W在周期表中的位置 。写出X的稀溶液与Z反应的离子方程式 。
②X的浓溶液与W在加热条件下反应生成气体Q,已知Q受热发生可逆的分解反应,
1mol Q分解时,有2 mol电子转移。Q发生分解反应的化学方程式是
。将Q装入密闭容器中,加热到T ℃,达平衡时,测得密闭容器中气体压强是反应开始时的1.25倍。Q的分解率为 。
查看答案和解析>>
科目: 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g);
2SO3(g); kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.Q1=Q2=Q3=197 kJ。
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1。
C.甲、乙、丙3个容器中反应的平衡常数不相等。
D.达到平衡时,丙容器中SO2的体积分数最小。
查看答案和解析>>
科目: 来源: 题型:
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是
| X | Y | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |


查看答案和解析>>
科目: 来源: 题型:
某溶液可能含有下列离子中的几种(不考虑溶液中微量的H+和OH-):Na+、NH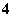 、SO
、SO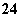 、CO
、CO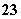 、NO
、NO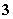 。取200 mL该溶液,等体积分成两份,分别做下列实验。
。取200 mL该溶液,等体积分成两份,分别做下列实验。
实验一:第一份加入足量烧碱并加热,产生的气体在标准状况下为224 mL。
实验二:第二份先加入足量的盐酸,无现象,再加入足量BaCl2溶液,得沉淀2.33 g。
A.该溶液可能含有Na+ B.该溶液一定含有NH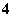 、SO
、SO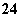 、CO
、CO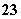 、NO
、NO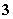
C.该溶液一定不含有NO D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
下列图示与对应的叙述相符的是

A. 图1所示的总反应为吸热反应。
B. 图2所示实验为用0.01 mol·L-1的HCl溶液滴定20 mL 0.01 mol·L-1的NaOH溶液。
C. 图3可以表示反应CO(g)+2H2(g) CH3OH(g)的平衡常数K随压强p变化的关系。
CH3OH(g)的平衡常数K随压强p变化的关系。
D. 图4可以表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系。
查看答案和解析>>
科目: 来源: 题型:
下列实验现象、解释与结论均正确的是
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
| B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该沉淀是BaSO4,该溶液中只含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水退色 |
| D | 在稀AgNO3溶液中先加入少量0.1mol·L-1 NaCl溶液,再加入少量0.1mol·L-1 NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目: 来源: 题型:
有关下列两种溶液的说法中,正确的是
溶液①:0.2 mo1·L-1 CH3COONa溶液 溶液②:0.1 mo1·L-1H2SO4溶液
A.相同温度下,溶液中水的电离程度:溶液① < 溶液②。
B.加水稀释溶液①,溶液中 变大。
变大。
C.等体积混合溶液①和溶液②,所得溶液中c(CH3COO-) + 2c(SO42-) = c(Na+)。
D.25℃时,向溶液②中滴加溶液①至pH = 7,溶液中c(Na+) > c(SO42-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com