
科目: 来源: 题型:
随着社会的发展,人们日益重视环境问题。下列做法或说法正确的是
A.提倡使用一次性发泡塑料餐具和塑料袋
B.绿色化学的核心是应用化学原理治理环境污染
C.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
D.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
查看答案和解析>>
科目: 来源: 题型:
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是:
;
②写出由CaCl2通过化合反应制备CaCl的化学方程式:
。
查看答案和解析>>
科目: 来源: 题型:
Q、W、X、Y、Z五种短周期元素,原子序数依次增大。Q在元素周期表中原子半径最小,W元素最高正价与最低负价代数和为0;Y与Q同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)X、Z简单离子半径较大是 (用离子符号表示)。
(2)由这五种元素中的若干种组成的化合物甲、乙、丙、丁在水溶液中有如下转化关系:

其中丙是溶于水显酸性的气体,丁是强碱。
①若乙常作为焙制糕点的发酵粉,则乙含有的化学键类型有 ;乙溶液中阳离子浓度之和 阴离子浓度之和(填“>”、“=”或“<”)。
②若乙是难溶物,甲溶液与过量的丙生成乙的离子方程式为:
。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
Ⅰ 取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(1)搅拌的目的是 。
(2)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是 ,溶液中c(Pb2+) (填“增大”、“减小”或“不变”)。
Ⅱ 准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5 mol。
(3)在此实验温度下,PbI2的溶度积常数Ksp= 。
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,Ksp测定结果将会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组用以下装置探究SO2的某些化学性质。

(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目: 来源: 题型:
将2mol H2和1mol CO2充入体积为10L的恒容密闭容器中,在一定条件下发生反应:
①CO2(g) + H2(g) CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
②CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
反应100min后达到平衡,测得下表数据:
| 温度 | 转化率(%) | 物质的量(mol) | ||
| H2 | CO2 | CH3OH | CO | |
| 240℃ | 10 | 0.05 | 0.05 |
下列说法正确的是
A.升高温度,反应①的平衡常数减小
B.升高温度,CH3OH的含量提高
C.H2转化率为10%
D.100min内,反应②的速率为v(CO2)=0.0001 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
用右图所示装置制取纯净的Fe(OH)2,下列说法不正确的是
A.a电极一定是铁,电解液c可以是CuCl2溶液
B.电解一段时间,b电极附近pH升高
C.溶液中的阴离子向a电极移动
D.在加入苯之前应将电解液c加热煮沸

查看答案和解析>>
科目: 来源: 题型:
常用图像直观地描述化学反应的进程或结果。下列有关图像的描述正确的是
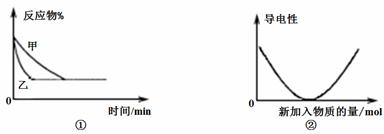
A.图①可表示温度对“A2(g) + 3B2(g) 2AB3(g) △H<0”的影响
2AB3(g) △H<0”的影响
B.图①可表示压强对2A(g) + 2B(g) 3C(g) +D(s)的影响
3C(g) +D(s)的影响
C.图②可表示醋酸溶液中通入氨气至过量,溶液导电性的变化
D.图②可表示Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com