
科目: 来源: 题型:
下列说法不正确的是:
A.有机化合物分子中的某个原子(或原子团)被另一个原子(或原子团)所替代的反应,叫取代反应
B.结构相似,分子组成相差1个或若干个“CH2”原子团的有机物互称为同系物
C.从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
D.塑料、合成纤维、合成橡胶统称为三大合成材料
查看答案和解析>>
科目: 来源: 题型:
芳香化合物A( )在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
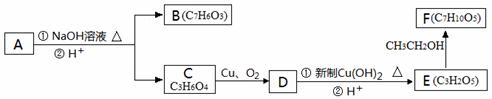
请回答下列问题:
(1)请写出A的分子式
(2)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol
(3)有机物C可以由乳酸(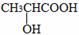 )经过几步有机反应制得,其中最佳的次序是:
)经过几步有机反应制得,其中最佳的次序是:
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化 d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式: ,反应类型是
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式C9H8O4),满足以下条件的阿司匹林的同分异构体有 种,写出其中核磁共振氢谱是3:2:2:1的结构简式: 、
①苯环上只含有两个侧链 ②有两个酯基 ③能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
 |
请回答下列问题:
(1)表中属于d区元素的是 (填编号)。
(2)写出基态⑨原子的电子排布式 。
(3)元素⑦形成的RO32- 含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(4)元素①的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,①原子采用sp2杂化
(5)元素⑦(用X表示)的氢化物和元素③(用Y表示)的一种氢化物的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
H2X和H2Y2相对分子质量基本相同,造成上述物理性质差异的主要原因
、 。
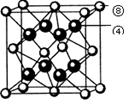 (6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
(6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
查看答案和解析>>
科目: 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
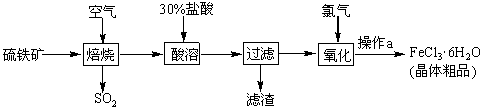
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 ,该反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 。
(3)操作a为 、过滤、洗涤、干燥,获得FeCl3·6 H2O。
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表:
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
①根据表中的数据判断该反应的正向属于 (填“放热”或“吸热”)反应,理由是 。
②在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是
;
(5)计算每生产1万吨98%硫酸所需要含80% FeS2的 吨(假设反应过程中硫的利用率为90%,结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是 (填序号)。
A.每一个水分子内含有两个氢键
B.水分子间存在范德华力,所以水分子稳定
C.分子间形成的氢键使水的熔点和沸点升高
D.冰熔化时水分子内共价键发生断裂
(2)科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”,则“暖冰”中水分子的空间构型为 。
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有
(回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e-== Na2Mn5O10,请写出电池总反应式 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(III)的化学方程式 。
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,反应(III)的离子方程式为 。
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(III)中氧化产物与还原产物的物质的量之比为 。0.1mol A与含0.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为 。
②25℃时,0.1mol·L-1 B、C溶液,pH较大的是 溶液(填溶质的化学式),写出B溶液中微粒浓度之间存在的等量关系 (写出一种即可)。
查看答案和解析>>
科目: 来源: 题型:
CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用。
(1)用甲烷可以消除氮氧化物的污染,其反应如下:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(1)130℃时,达到平衡状态时CH4的转化率为 。当温度为180℃、反应到40 min时,该反应 (填“是”或“否”)达到平衡,推断的依据是 。
(2)由表中数据分析可知,该反应的ΔH 0(填“=”、“﹥”或“﹤”),130℃和180℃平衡常数的关系:K(130℃) K(180℃)(填“=”、“﹥”或“﹤”)。
 (3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a电极上发生反应的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填“增大”、“减小”或“不变”)。
③若完全反应后,装置Ⅱ中Cu极质量减少12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(4)用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
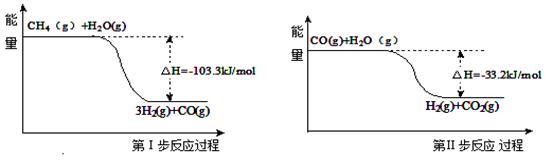
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com