
科目: 来源: 题型:
已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH值 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
请你判断下列反应不能成立的是:
A.CO2 +H2O+ NaClO== NaHCO3+HClO
B.CO2 +H2O+ 2NaClO== Na2CO3+2HClO
C.CH3COOH+ NaCN== CH3COONa+HCN
D.CH3COOH+ NaClO== CH3COONa+ HClO
查看答案和解析>>
科目: 来源: 题型:
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2 + H2O == ZnO + 2MnO (OH) 。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.l mol Zn 完全反应时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2H2O + 2e - ==2MnO (OH) + 2OH-
查看答案和解析>>
科目: 来源: 题型:
COCl2(g) 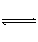 CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是
,下列关于该有机物的叙述不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与氢气发生加成反应
C.在铜的催化作用下,能被氧化成羧酸类物质
D.在浓硫酸催化下,能与乙酸发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.只有NH4+ B.只有Mg2+ C.Fe2+ 和Al3+ D.NH4+ 和Fe2+
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能发生
查看答案和解析>>
科目: 来源: 题型:
向5 mL 0.1 mol·L-1 的KI溶液中滴加5~6滴0.1 mol·L-1 的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色
查看答案和解析>>
科目: 来源: 题型:
在指定环境下,下列各组离子可以大量共存的是
A.在无色透明溶液中:Al3+、Na+、HCO3-、Cl-
B.在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I-
C.加入铝粉放出氢气的溶液: K+、Ca2+、NO3-、SO42-
D.在水电离产生的H+的浓度为1×10-13mol・L-1的溶液:Cu2+、Na+、NO2-、SO42-
查看答案和解析>>
科目: 来源: 题型:
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是


A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- = 4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com