
科目: 来源: 题型:
下列影响化学反应的本质原因分析错误的是
A.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增加
B.有气体参加的化学反应,若缩小反应容器的体积,主要增大了活化分子的百分数
C.升高温度,主要增加了反应物分子中活化分子数
D.加入催化剂后,活化分子数增大,活化分子百分数也增大
查看答案和解析>>
科目: 来源: 题型:
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
 d.液化生成物分离出氨
d.液化生成物分离出氨
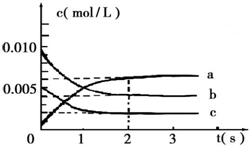
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)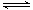 2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
①用O2表示从0~2s内该反应的平均速率
v=___________。
②能说明该反应已经达到平衡状态的是
_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
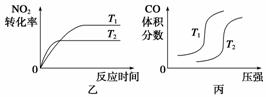
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。

查看答案和解析>>
科目: 来源: 题型:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K= 。 0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时, 容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
① 表中3min~4min之间反应处于______状态; c 1数值_____0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
查看答案和解析>>
科目: 来源: 题型:
金属镁及其化合物不仅在国防上有重要应用,在化学
研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:
取一段镁条,用砂纸擦去表面的氧化膜,使足量
镁条与一定量盐酸反应生成H2的量与反应时间
 的关系曲线如图所示。镁与盐酸反应的离子方程
的关系曲线如图所示。镁与盐酸反应的离子方程
式为 ;
在前4min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,
写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
查看答案和解析>>
科目: 来源: 题型:
(1)有下列物质 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O
⑥熔融NaCl ⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度
c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)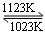 TaI4(g) + S2(g),下列说法错误的是( )
TaI4(g) + S2(g),下列说法错误的是( )
A.在不同温度区域,TaI4 的量不同
B.在提纯过程中,S2 的量不断增多
C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大
D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区

查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)  2NH3(g)(正反应为放热反应)。下列说法错误的是( )
2NH3(g)(正反应为放热反应)。下列说法错误的是( )
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是 1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com