
科目: 来源: 题型:
在某无色透明溶液中能大量共存的一组离子是
A.Na+、Fe2+、MnO4-、NO3-
B.Al3+、NH4+、Br-、OH-
C.Na+、K+、SO42-、ClO-
D.K+、Ca2+、NO3-、CO32-
查看答案和解析>>
科目: 来源: 题型:
下列实验不能达到预期目的的是
A.用溴水鉴别CO2和SO2
B.用Ba(NO3)2溶液鉴别Cl-和CO32-
C.通过直接观察焰色反应的颜色鉴定某单一溶液中是否含Na+
D.用润湿的pH试纸测定某酸溶液的pH
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.溶液是电中性的,胶体是带电的
B.依据丁达尔效应可区分透明胶体和溶液
C.将4.0g NaOH溶于100g蒸馏水中,所得溶液物质的量浓度为1.0mol·L-1
D.CO2与SiO2都属于酸性氧化物,都能与水反应生成相应的酸
查看答案和解析>>
科目: 来源: 题型:
下列有关化学用语表示正确的是
A.质子数为53,中子数为78的碘原子:78 53I
B.乙烯的结构简式:CH2CH2
C.S2-的结构示意图: 
D.CH4分子的比例模型:
查看答案和解析>>
科目: 来源: 题型:
下列关于化学与生产、生活的认识不正确的是
A.普通铅笔芯的主要成分是铅
B.煤的气化和液化过程均属化学变化
C.硅酸钠溶液俗名水玻璃,可用于制备硅胶和木材防火剂
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
查看答案和解析>>
科目: 来源: 题型:
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 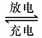 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过
2mol电子时,理论上负极板的质量增加 g。
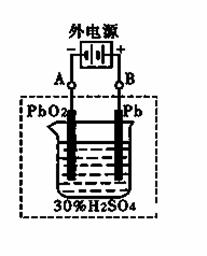
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板
按右图连接,电解一段时间后,则在A电极上生成 __________,B电极上?生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目: 来源: 题型:
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 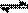 CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的△H 0
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
 (3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
(3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
查看答案和解析>>
科目: 来源: 题型:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
 CO(g) +H2O(g)
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如右图,则在该温度下,该反应
的平衡常数K= 。
0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,
容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
查看答案和解析>>
科目: 来源: 题型:
.I.下列四支试管中,过氧化氢分解的化学反应速率最大的是
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。
 (2)写出实验③的化学反应方程式 。
(2)写出实验③的化学反应方程式 。
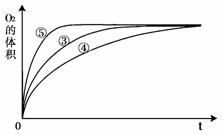
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如右图。
分析右图能够得出的实验结论是
_________________________。
查看答案和解析>>
科目: 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
 |
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为 ,该还原剂反应后生成 。
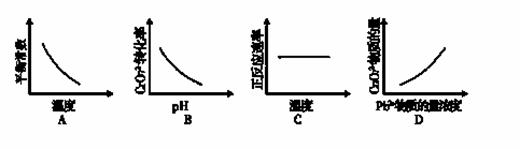
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
[]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com