
科目: 来源: 题型:
下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.SO2、O2、N2 B.HCl、Cl2、CO2
C.CH4、H2、CO D.SO2、Cl2、O2
查看答案和解析>>
科目: 来源: 题型:
用石灰石代替碱液处理酸性废水可降低成本。大多数情况下,利用石灰石处理含金属离子的酸性废水并不适用,原因在于酸与石灰石反应的限度,使溶液体系的pH不能达到6.0以上的排放标准。当酸性废水中含有Fe3+、Fe2+、Al3+时能利用石灰石处理该酸性废水,可使pH上升到6.0以上,达到满意效果,其研究步骤如下:
Ⅰ、向0.1mol/L 盐酸,加入石灰石粉,当溶液体系 pH 升至5.6 时, 再继续加入石灰石粉无气泡冒出,说明此时已达溶解平衡。
Ⅱ、向含Fe3+、Fe2+、Al3+的酸性废水中加入适量的0.1mol/L 盐酸和30% H2O2溶液,充分反应。
Ⅲ、将Ⅱ中获得的溶液加入到Ⅰ溶液中,得到混合液x,测得混合液pH<2.0。
Ⅳ、向混合液x中加入石灰石粉,有大量气体产生,并逐渐有沉淀生成。pH 升到 6.2时停止加石灰石粉。
(1)HCl的电子式是 。
(2)石灰石与盐酸反应的离子方程式是 。
(3)从化学平衡的角度分析CaCO3与盐酸反应的原理 (用化学用语表示)。
(4)CaCl2溶液显中性,步骤Ⅰ中溶液体系 pH = 5.6的原因是 。
(5)步骤Ⅱ中反应的离子方程式是 。
(6)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释步骤Ⅱ的目的: 。
(7)步骤Ⅳ中,当 pH 上升到 3.3 以上时,会促进Al3+的水解,Al3+水解的离子方程式是 。
(8)步骤Ⅳ中溶液体系的 pH 可上升到6.2,是因为生成Al(OH)3可与溶液中的HCO3-反应使c(CO32-)增大,该反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
|

|

|

 |
① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 (填字母)。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> > c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

① 氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
② 空气在进入电池装置前需要通过过滤器除去的气体是 。
③ 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是
查看答案和解析>>
科目: 来源: 题型:
醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:

 |
已知:
(1)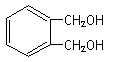
 中的含氧官能团的名称为 。
中的含氧官能团的名称为 。
(2)反应①的化学方程式是 。
(3)写出B的结构简式是 。
(4)反应①~③中属于取代反应的是 (填序号)。
(5)反应④的化学方程式为是 。
(6)反应⑤的化学方程式是 。
(7)下列说法正确的是 (填字母)。
a.B存在顺反异构
b.1 mol E与足量的银氨溶液反应能生成2 mol Ag
c.F能与NaHCO3反应产生CO2
d.丁烷、1-丙醇和D中沸点最高的为丁烷
(8)写出符合下列条件的与
 互为同分异构体的结构简式 。
互为同分异构体的结构简式 。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A.乙醇和浓硫酸反应制乙烯时,利用NaOH溶液可除去杂质气体
B.向饱和Na2CO3溶液中通入足量CO2,可析出NaHCO3,使溶液变浑浊。
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
查看答案和解析>>
科目: 来源: 题型:
镁锰干电池的电化学反应式为:Mg+2MnO2+H2O  Mg(OH)2+Mn2O3。下列说法不正确的是
Mg(OH)2+Mn2O3。下列说法不正确的是
A.镁为负极,发生氧化反应
B.可以选择碱性溶液作为电解质
C.反应后正极和负极附近溶液的pH均升高
D.正极的电极反应为:2MnO2+H2O+2e- Mn2O3 +2OH-
Mn2O3 +2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com