
科目: 来源: 题型:
甲、乙、丙三种醇与足量金属钠完全反应,在相同条件下产生体积相同的氢气,而消耗这三种醇的物质的量之比为3:6:2,则甲、乙、丙三种醇分子里羟基数之比为( )
A.3:1:2 B.2:3:1 C.2:1:3 D.3:2:1
查看答案和解析>>
科目: 来源: 题型:
既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的乙烯的方法是( )
A.通入足量溴水中 B.在空气中燃烧
C.通入酸性高锰酸钾溶液中 D.在一定条件下通入氢气
查看答案和解析>>
科目: 来源: 题型:
苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应
过程如下:

甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |
|
| 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 ▲ (填“上”或“下”)层;实验操作的名称是 ▲ 。
(2)步骤②用浓盐酸酸化的目的是 ▲ 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 ▲ 、 ▲ (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 ▲ 。
(5)重结晶时需要趁热过滤,目的是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若都做,则按A小题评分。
A.[物质结构与性质]
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同
的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子
的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原
子序数为24。
(1)F原子基态的核外电子排布式为 ▲ 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 ▲ (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 ▲ 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 ▲ 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 ▲ 。
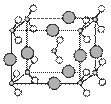 (6)由B、C、D三种元素形成的化合物晶体的晶胞如右图
(6)由B、C、D三种元素形成的化合物晶体的晶胞如右图
所示,则该化合物的化学式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=—92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=—159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O (l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 ▲ 。
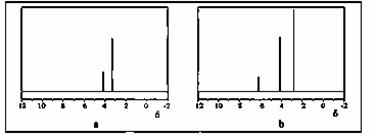
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 ▲ 。
该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为
下图中的 ▲ (填“a”或“b”)。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 ▲ 。
(4)已知H2S高温热分解制H2的反应为:
H2S(g) H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S的分解实验:
 以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中
以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中
a为H2S的平衡转化率与温度关系
曲线,b曲线表示不同温度下反应
经过相同时间且未达到化学平衡时
H2S的转化率。
若985℃时,反应经t min达到平衡,
此时H2S的转化率为40%,则反应
速率v(H2)= ▲ (用含c、t的代
数式表示)。
 请说明随温度的升高,曲线b向曲线a逼近的原因: ▲ 。
请说明随温度的升高,曲线b向曲线a逼近的原因: ▲ 。
(5)用惰性电极电解煤浆液的方法制H2的反应为:
C(s)+2H2O(l)=CO2(g)+2H2(g)
现将一定量的1 mol·L-1 H2SO4溶液和适量煤
粉充分混合,制成含碳量为0.02 g·mL-1~0.12
g·mL-1的煤浆液,置于右图所示装置中进行电
解(两电极均为惰性电极)。则A极的电极
反应式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分
反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式: ▲ ;加入铁粉的作用有 ▲ 、 ▲ 。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是 ▲ 。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率 ▲ (填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙
醇的作用是 ▲ 、 ▲ 。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净
的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶
液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤, ▲ ,过滤,得到较
纯净的FeSO4溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com