
科目: 来源: 题型:
(1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质: NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:SiO2(CaCO3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:Na2CO3 Na2SiO3 Na2SO3 溶液 | |
| ⑤ | 鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液 |
(2)氧化还原是常见的反应类型,根据信息回答以下问题:
“四种基本反应类型与氧化还
原反应的关系”也可用右图表
 达。其 中Ⅰ为化合反应,则
达。其 中Ⅰ为化合反应,则
Ⅱ为 反应。写出一个
有水生成的符合反应类型Ⅲ
的化学方程式: 。写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,其中水作为 剂。(填氧化剂、还原剂等)
(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,
溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
(1) a、b、c中反应的离子方程式为:
。
e中的化学反应方程式为 。
上述反应中发生了氧化还原反应的是: (填“a”、“b”、“c”或“e”)。
(2)能证明氯水具有漂白性的现象是____________________________。
(3)久置的氯水变为________,用化学反应方程式表示为__________。
(4)实验室保存饱和氯水的方法是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达错误的是
|
C.质量②>③>①>④ D.氢原子个数①>③>④>②
查看答案和解析>>
科目: 来源: 题型:
某无色混合气体中可能含有O2 、SO2 、NO 、NO2 、CO、CO2中的气体。现将此透明的混合气体通过品红溶液后,品红溶液褪色,再通入澄清石灰水,石灰水变浑浊。把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中错误的是
A. 肯定有SO2、CO2 和NO B. 肯定没有O2和NO2
C. 可能有CO和CO2 D.肯定有SO2 和NO
查看答案和解析>>
科目: 来源: 题型:
下列各选项最后的物质是要制取的物质,其中能够得到的是
A.CaCO3  CaO
CaO 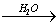 Ca(OH)2
Ca(OH)2 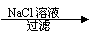 NaOH溶液
NaOH溶液
B. Cu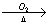 CuO
CuO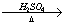 CuSO4溶液
CuSO4溶液 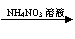 Cu(NO3)2溶液
Cu(NO3)2溶液
C.KMnO4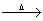 O2
O2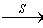 SO3
SO3 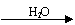 H2SO4
H2SO4
D .NH3  NO
NO 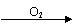 NO2
NO2 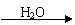 HNO3
HNO3
查看答案和解析>>
科目: 来源: 题型:
某同学用下列装置制备并检验Cl2的性质。
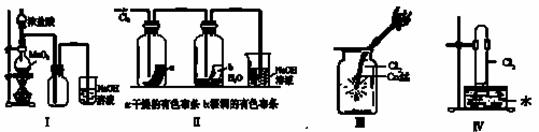
下列说法错误的是
A.Ⅰ图中:即使MnO2过量,盐酸也不能全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成棕色的烟
D.Ⅳ图中:水可以充满试管
查看答案和解析>>
科目: 来源: 题型:
下列各组中两种物质在溶液的反应,能用同一离子方程式表示的是
A.铁和稀盐酸、铁和稀硝酸
B.铜和浓硝酸、铜和稀硝酸
C.NaHCO3 + NaOH; NaHSO4 + NaOH
D.BaCl2 + H2SO4; Ba(OH)2 + Na2SO4
查看答案和解析>>
科目: 来源: 题型:
下列离子在碱性溶液中能大量共存,并且溶液为无色透明的是
A.Na+、Cu2+ 、SO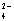 、OH— B.K+、Ba2+、Cl—、NO3—
、OH— B.K+、Ba2+、Cl—、NO3—
C.Na+、Cl—、Ca2+、MnO4— D.Na+、HCO3—、SO42—、Cl—
查看答案和解析>>
科目: 来源: 题型:
用NA代表阿伏加德罗常数,下列说法正确的是
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
B.标准状况下,11.2 L H2O 所含的分子数为0.5NA
C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
D.18g H2O 和H2O2 的混合物含有的分子数为1NA
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法错误的是
A.溶液中Na+数目减少,有固体析出
B.溶液中Na+数目减少,有气体逸出,
C.溶液中H2O数目减少,溶质的质量分数增大
D.溶液中H2O数目减少,溶质的质量分数未变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com