
科目: 来源: 题型:
工业生产SO3的反应为:2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测得容器中有0.08mol的SO3(g)。试求在该温度下:
2SO3(g) ,若在一定温度下,将0.1mol的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测得容器中有0.08mol的SO3(g)。试求在该温度下:
(1)SO2(g)的平衡转化率。 (2)此反应的平衡常数。
查看答案和解析>>
科目: 来源: 题型:
烧碱在保存过程会部分变质(杂质主要为Na2CO3)。某同学进行以下操作测定放置已久的NaOH纯度。请回答有关问题:
准确称取5.000g样品配制成250mL溶液,各取配制好的烧碱溶液20.00mL于三个大试管中,分别滴入过量的BaCl2溶液,用离心机分离后将滤液转移到三个锥形瓶中(用蒸馏水充分洗涤沉淀,洗涤液也转至锥形瓶中);向锥形瓶中各加入1~2滴指示剂(现有酸碱指示剂及变色的pH范围为:①甲基橙3.1~4.4 ②酚酞8.2~10),用浓度为0.2000mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 滴定前读数 | 滴定末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
(1)向NaOH溶液中滴入盐酸,若选用 做指示剂,判断到达滴定终点的实验现象是 。
(2)依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %(保留4 位有效数字)。
位有效数字)。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是 。
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数
查看答案和解析>>
科目: 来源: 题型:
回收锌锰废电池可生产硫酸锌、碳酸锰等。原料锰粉主要成分为MnO2和碳,含少量锌和铁。焙烧反应之一为:MnO2+C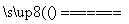 MnO+CO↑。生产工业级碳酸锰流程如下:
MnO+CO↑。生产工业级碳酸锰流程如下:

回答下列问题:
(1)第二步用稀H2SO4浸取时需加热,其原因是: 。
(2)第三步加入过量酸化的H2O2溶液,其目的是 ,离子方程式为 ;然后将pH调到7.8~8.7(四种离子沉淀的pH范围如右表),其目的是 。
| 化学式 | 开始沉淀时pH值 | 沉淀完全时的pH值 |
| Mn(OH)2 | 8.8 | 10.4 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe (OH)3 | 2.7 | 3.7 |
| Zn(OH)2 | 6.4 | 7.8 |
查看答案和解析>>
科目: 来源: 题型:
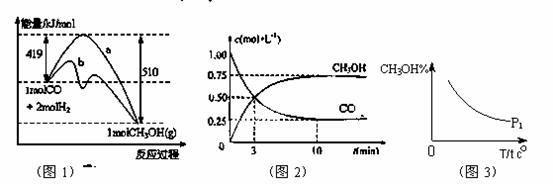
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
 请回答下列问题:
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反 应。
应。
(2)下列说法正确的是
A.该反应的反应热为:△H= 91kJ·mol-1 B.起始充入的CO为2mol
C.容器中压强恒定时,反应已达平衡状态 D..增加CO浓度,CO的转化率增大
E.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时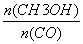 会减小
会减小
(3)从反应开始到建成平衡, v(H2)=________;请在“图3”中画出甲醇百分含量随温度T变化的P2曲线,且P1<P2。
(4)以甲醇、空气为主要原料,KOH溶液为电解质溶液,铂为电极构成燃料电池。则该电池中负极上的电极反应式为 。
(5)已知在常温常压下:
①H2O(g) = H2O(l) ΔH1=-44.0 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③2CH3OH(l) + 3O2(g) = 2CO2 (g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
(g) + 4H2O(g) ΔH3=-1275.6 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
化学反应原理与生产生活密切相关,请回答:
(1)实验室将适量绿矾(FeSO4﹒7H2O)溶解于足量蒸馏水,发现有些发黄和浑浊,此时应采取的措施是  。
。
(2)人的牙齿的化学成份为羟基磷酸钙[Ca10(PO4)6(OH)2],常喝酸性饮料或口腔中残留的酸性物质都会造成龋齿。如果刷牙使用含氟牙膏(含F-)可以保护牙齿,其原理是 。
(已知25℃时Ksp[Ca10(PO4)6(OH)2]=6.8×10-37,KsP [Ca5(PO4)3F]=2.8×10-61)。
查看答案和解析>>
科目: 来源: 题型:
填写下列空格:
(1)把AlCl3溶液蒸干直至得到干燥的固体,则固体主要成份是 ;草木灰(含K2CO3)显碱性的原因是(用离子方程式表示) ,所以 (填:“能”或“不能”)与铵态氮肥混合施用。
(2)室温下pH=9的NaOH溶液中,由水电离产生的c(OH-)为 mol/L;把0.1mol/LHCl与0.3mol/L的NaOH溶液等体积混合,所得溶液的pH= 。
(3)3mol/L 100mL H2SO4 溶液与足量的Zn反应,为使产生的H2 速率减慢,但产生的H2的总量不变,可采取的措施_______________(填下列选项的序号)。
H2SO4 溶液与足量的Zn反应,为使产生的H2 速率减慢,但产生的H2的总量不变,可采取的措施_______________(填下列选项的序号)。
A.加醋酸钠固体 B.加NH4Cl溶液 C.加BaCl2溶液 D.加氨水
查看答案和解析>>
科目: 来源: 题型:
请回答:
(1)从能量角度看,断开化学键吸收能量,形成化学键 能量;则反应:H2(g)+ Cl2(g)=2HCl(g)的△H= (已知键能:H—H为436kJ/mol;Cl—Cl为243 kJ/mol;H—Cl为431 kJ/mol)。
(2)将含1mol/L稀H2SO4与略过量的1mol/LNaOH溶液按体积比1L与2L中和,测得放热114.6kJ,则强酸与强碱反应的中和热的数值为 kJ/mol。
(3)某小组用KMnO4酸性溶液与H2C2O4(有还原性)溶液反应,以溶液紫色消失快慢的方法,研究影响反应速率的因素。请完成以下实验设计表:
| 实验编号 | T/K | 催化剂的用量/ g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和 探究温度对反应速率的影响; c. 实验①和④探究 对反应速率的影响。 |
| ② | 0.5 | 0.001 | ||
| ③ | 323 | 0.010 | ||
| ④ | 298 | 0 | 0.010 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com