
科目: 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:


已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
查看答案和解析>>
科目: 来源: 题型:
铁明矾[xFeSO4·yAl2(SO4)3·zH2O]是一种重要化工原料。其组成可通过下列实验测定。
①称取1.8520 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0100 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,则应保持溶液中c(Ba2+)≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
工业上从煤干馏粗产品煤焦油中可以分离出萘,以萘为主要原料合成除草剂敌草胺的流程图如下:
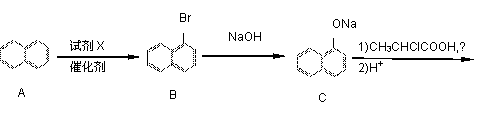

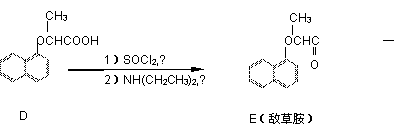

(1)A生成B时,有另一种一溴代物副产物,它的结构简式为 。
(2)试剂X是 。
(3)向C的水溶液中通入少量的二氧化碳会析出有机物W和无机物,写出化学反应方程式:
;W是一种常用的抗氧剂,理由是 。
(4)同时符合下列条件的D的同分异构体有多种:①能遇氯化铁溶液变紫色;②能发生水解反应;③它是A的衍生物;④在稀硫酸中水解,得到的含环产物在核磁共振谱图上有4个信号峰,另一种产物在核磁共振谱图上峰值比为3:2:1。写出其中一种同分异构体的结构简式: 。
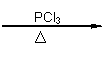 |
(5)已知:RCH2COOH RCHClCOOH;
 |
请以苯酚、乙醇为有机原料,制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目: 来源: 题型:
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:


(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为
。
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在 离子(填写离子符号),检验溶液中还存在Fe2+的方法是 (写明步骤、试剂和现象)。
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)的化学式为 。
(4)第③步反应化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙 B.平衡时,丙中c(SO3)是甲中的2倍
C.该温度下,平衡常数值为400 D.平衡时,SO2的转化率:α1<80%<α2
查看答案和解析>>
科目: 来源: 题型:
 某温度下,向一定体积0.10mol•L—1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=—lg(OH—)] 与pH的变化关系如图所示,则
某温度下,向一定体积0.10mol•L—1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=—lg(OH—)] 与pH的变化关系如图所示,则
A.在反应过程中P点水的电离程度最大
B.M点和Q点溶液导电能力相同
C.反应过程中一定存在:
0.1mol·L—1+c(OH—)=c(Na+)+c(H+)+c(CH3COOH)
D.Q点对应的溶质可能有三种可能:
①CH3COONa ②CH3COONa、CH3COOH ③CH3COONa、NaOH
查看答案和解析>>
科目: 来源: 题型:
下列实验或方案正确的是
A.在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有还原性
B.久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,再将该溶液滴入NaOH溶液,变红,说明酚酞易溶于酒精
C.在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2浊液并加热,无红色沉淀,说明淀粉未水解
D.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是
A.常温下,4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0
B.检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液
C.锌与稀硫酸反应时加少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp (BaCO3)<Ksp (BaSO4)
查看答案和解析>>
科目: 来源: 题型:
H7N9型禽流感是全球首次发现的新亚型流感病毒,达菲(Tamiflu)是治疗该病毒的最佳药物。以莽草酸为原料,经多步反应可制得达菲和对羟基苯甲酸。达菲、莽草酸、对羟基苯甲酸的结构简式如下:

达菲 莽草酸 对羟基苯甲酸
下列有关说法正确的是
A.达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物
B.1mol莽草酸与NaOH溶液反应,最多消耗4molNaOH
C.对羟基苯甲酸较稳定,在空气中不易被氧化
D.利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
查看答案和解析>>
科目: 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为H2EO4
D.C的单质在空气中燃烧产物的化学式为C2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com