
科目: 来源: 题型:
X是一种抗菌药,用于治疗急、慢性溃疡性结肠炎,其结构简式如右图。

以有机物A为原料合成X的路线如下:

已知:
回答下列问题:
(1)写出A中含有的官能团的名称________。
(2)写出下列反应的反应类型:③____________;④____________。
(3)写出E的结构简式__________。
(4)写出第②步反应的化学方程式__________。
(5)在第一步反应中可能会生成一种高聚物的副产物,写出该副产物的结构简式____________。
(6)B有多种同分异构体,写出同时符合下列条件B的所有同分异构体结构简式__________。
① 能发生银镜反应;② 一定条件下与NaOH溶液完全反应,需消耗2 mol NaOH; ③ 分子结构中不含甲基;④ 苯环上有2种不同化学环境的氢。
查看答案和解析>>
科目: 来源: 题型:
乙酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
 |
实验步骤
① 取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
② 反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③ 将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品。
(1)步骤①研碎块状产物的用意在于 ;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有 ;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0 mL乙酸酐
C.玻璃棒将块状物研碎 D.加20ml水
(2)步骤②洗涤粗产品时,选用的溶剂是 ;
A.热水 B.冷水 C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择 (过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去 ;配制热溶液时,加入过量溶剂的作用是
(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时可选择 ;
A.冰水浴冷却 B.搅拌下水浴冷却
C.室温下自然冷却 D.投入少量碎冰后静置
(5)步骤③中以下哪些操作不能提高产率 ;
① 配制成饱和溶液后,加入过量20%的溶剂;② 趁热过滤近沸溶液;③ 过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;④ 加活性炭吸附;⑤ 过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体。
A.①④⑤ B.①④ C.④⑤ D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol。该实验的产率为 (保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
研究化肥的合成、废水的处理等有现实的重要意义。
Ⅰ.尿素是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
 |
① 已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
② 反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
③ 第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0
(填“>”“<”或“=”)
Ⅱ.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(3)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,
c(AsO43-)最大是 mol·L-1。
(4)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(5)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
① 将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
② Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 。
查看答案和解析>>
科目: 来源: 题型:
将1.00 mol·L-1 NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
(1)计算室温时20.00 mL 1.00 mol·L-1的一元酸
HA的电离度α=________。
 (2)图中B点所示的溶液中所含各离子浓度由
(2)图中B点所示的溶液中所含各离子浓度由
大到小的顺序是_____。
(3)下列说法正确的是________(填相应序号)。
A.由图中可知NaOH和HA反应的ΔH>0
B.图中C点所加NaOH溶液的体积V=20.00 mL
C.图中C点时溶液的KW略大于1×10-14 mol·L-1,溶液中c(H+)=1×10-7 mol·L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入
0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的
部分情况如图所示。]回答下列问题:
① 在同一溶液中,H2CO3、HCO 、CO
、CO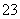
______(填“能”或“不能”)大量共存;
② 当pH=7时,溶液中含碳元素的主要微粒为________,溶液中各种离子的物质的量
浓度的大小关系为________________________________;
③ 已知在25 ℃时,CO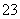 水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
液中c(HCO )∶c(CO
)∶c(CO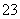 )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目: 来源: 题型:
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+ 、HCO3-、CO32-、Cl-、NO3-、SO42- 中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。则下列说法正确的是
A.原溶液中一定含有HCO3-或CO32-
B.原溶液中可能含有Ba2+、Al3+
C.若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g

查看答案和解析>>
科目: 来源: 题型:
可逆反应A(g)+3B(g)  2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且固定不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=2Q2。下列叙述正确的是
2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且固定不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=2Q2。下列叙述正确的是
A.甲中A的转化率为75%
B.Q1 + Q2 < Q
C.达到平衡后,再向乙中加入1/3 molA、1 molB、4/3 molC,平衡向正反应方向移动
D.乙中热化学方程式为2C(g) A(g)+3B(g);△H= + Q2 kJ/mol
A(g)+3B(g);△H= + Q2 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com