
科目: 来源: 题型:
右图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
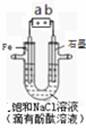 A.a 为电源的正极
A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH——4e-==2H2O+O2↑
D.电解饱和食盐水的总反应是:2NaCl + 2H2O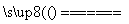 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
C.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)> V(NaOH)
D.AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)∙ c(X−),故KSP(AgI) > KSP(AgCl
查看答案和解析>>
科目: 来源: 题型:
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是( )
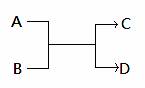 A.若A为Fe,D为氢气,则B一定为酸
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN−、SO42−
B.pH=0的溶液:Al3+、Ag (NH3)2+、Cl−、SO42−
C.c(H+)/c(OH−)=10−10的溶液:K+、Ba2+、NO3−、Cl−
D.c( ClO− )=1.0 mol·L−1的溶液:Na+、SO32−、S2−、SO42−
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是( )
A.NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂
B.工业上制H2SO4过程中SO2氧化条件一般选择高温、高压、催化剂
C.浓H2SO4有强氧化性,常温下能与Cu发生反应
D.将C12通入冷的消石灰中可制得漂白粉
查看答案和解析>>
科目: 来源: 题型:
将4.2克某金属溶于240mL稀硝酸溶液,反应中收集到标准况下的NO 1.68L,然后又向稀硝酸中加入该金属的氧化物RO 6.48g,恰好完全反应,并放出气体,反应完全后,溶液中的金属离子为R3+。请填空:
⑴金属R的相对原子质量是_______
⑵原稀硝酸溶液的物质的量浓度是____________________mol/L
⑶反应中被还原的硝酸的物质的量是_________mol
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组欲设计使用如下装置探究:铜和一定量的浓硝酸反应是否有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
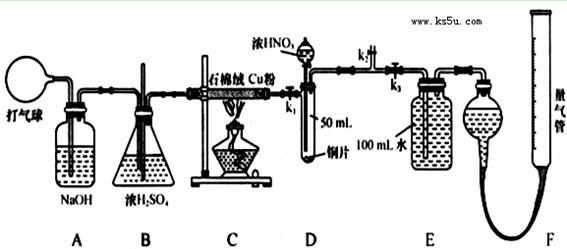
试回答下列问题:
(1)铜粉的作用是________________________________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是__ _(填化
学式),进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:_________ ;
(4)E装置中发生反应的化学方程式为____________________________________; 从E装置所得溶液中取出25.00mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则气体的成分为_________(填化学式),则铜和一定量的浓硝酸反应有______ mL NO生成。
查看答案和解析>>
科目: 来源: 题型:
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________A.
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________A.  B.
B. 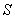 C.
C.  D.
D. 
②亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。
请选取一种合适的试剂证明Na2SO3具有还原性, 并写出该反应的化学方程式__________________________________
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由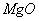 、
、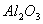 、
、 、
、 组成。其中属于碱性氧化物的是_________。
组成。其中属于碱性氧化物的是_________。
②现取一份蛇纹石试样进行实验:
I. 先将其溶于过量的盐酸中、过滤,滤渣的主要成分是_________。
II. 再向滤液中加入 溶液至过量、过滤,滤渣中的主要成分是_________。
溶液至过量、过滤,滤渣中的主要成分是_________。
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙之间有如下图所示的转化关系,其中甲物质为氧化物:
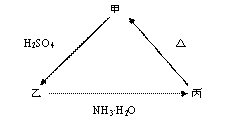
⑴ 若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,则甲的一种重要的工业用途是___________________________;
写出下列转化的方程式:
乙 丙的离子方程式_____________________________;
丙的离子方程式_____________________________;
丙 甲的化学方程式______________________________。
甲的化学方程式______________________________。
⑵若甲是不溶于水的黑色固体,且向乙溶液中加入KSCN溶液,混合溶液呈红色,
则甲物质的俗称是_______。
甲 乙的离子方程式是__________________________。
乙的离子方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com