
科目: 来源: 题型:
[化学──选修2:化学与技术] (15分)
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2) ①冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、______________________________;
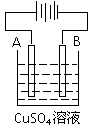 ②熔渣B的主要成分是_______________。
②熔渣B的主要成分是_______________。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)粗铜(含Fe、Ag、Pt、Au等杂质) 的电解精炼如图所示,A极上
发生的反应为__________________________________________,
下列说法正确的是 。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.阴阳两极质量变化相等
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,
其正极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
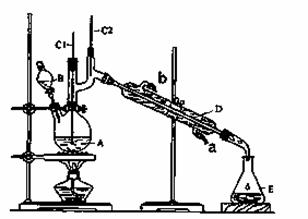
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH 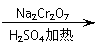 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸;②将所得溶液小心转移至B中;③在A中加入4.0g正丁醇和几粒沸石,加热;④当有蒸汽出现时,开始滴加B中溶液;⑤滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分;⑥将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.16g。
回答下列问题:
(1)实验装置中,_______(填图中的字母)处应与自来水龙头连接。
(2)该实验除了必要的仪器和试剂外还不可缺少的用品是________________。
(3)上述装置图中,C2仪器的名称是__________________,E仪器的名称是______________。
(4)进行实验前必须进行的操作是____________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛应从_________(填正确答案标号)。
a. 下口放出 b. 上口倒出
(6)反应温度应保持在90—95℃,其原因是为了将正丁醛及时分离出来,促使反应正向进行和减少正丁醛的进一步氧化,该氧化反应的方程式是__________________________。
(7)本实验中,正丁醛的产率为_____________%。
查看答案和解析>>
科目: 来源: 题型:
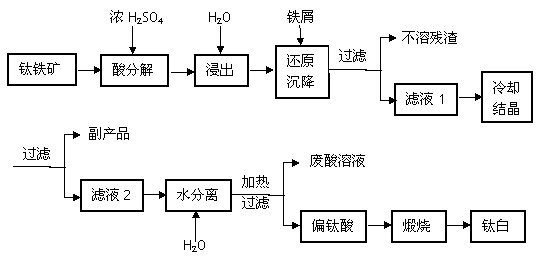
工业常用浓硫酸分解钛铁矿FeTiO3(含有FeO、Fe2O3杂质)方法来制备钛白(TiO2)工艺流程如下图所示。
 金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。
金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。
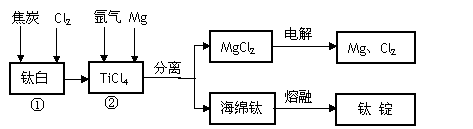

回答下列问题:
(1)浓硫酸处理钛铁矿时生成两种硫酸盐且无气体放出,写出FeTiO3(Fe+2价)在浓硫酸中分解的反应方程式_____________________________________________________;
(2)加铁屑的目的是___________________________________(用离子方程式表示),滤液1冷却结晶得到副产品的俗称是______________________(写名称);
(3)滤液2稀释加热水解得到偏钛酸(H2TiO3)的方程式______________________________;
(4)冶炼金属钛时反应①通常在800~900℃的条件下进行,产物中还有一种可燃性无色气体,该反应的方程式为______________________________________________________。
(5) 冶炼金属钛时反应②也在800~900℃的条件下进行,反应中需要加入氩气的理由是___________________;反应后的产物中需要加入_____________才能达到分离的目的。
(6)已知25℃、100kPa时TiCl4为液态,实验测得该条件下12g镁反应能释放出266.1kJ 热量,反应②的热化学方程式为_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。
(1)亚磷酸是______元酸。
(2)PCl3水解可制取亚磷酸,反应的方程式是____________________________________。
(3)在H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-。
H++H2PO3-。
①某温度下,0.10mol·L-1的H3PO3 溶液pH =1.6,即溶液中 c(H+) =2. 5×10-2 mol·L-1。求该温度下,上述电离平衡的平衡常数K=________________(只考虑H3PO3的第一步电离,结果保留两位有效数字)。
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7 (填“ >”、“=”或“ <”)。
(4)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为___________________________________________________________________
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:


①阴极的电极反应为_____________________________________
②产品室中反应的离子方程式为________________________________________
(6) 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的 量随时间t的变化关系如下图,据图回答下列问题:
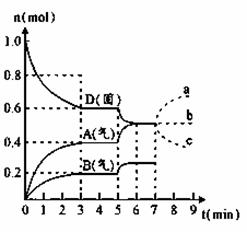 ①该化学反应的方程式是____________________。
①该化学反应的方程式是____________________。
②第5min时,若保持容器体积2.0L不变,改变条件,平衡移动如图所示,测得第4 min时的反应温度(T4)与第6min时的反应温度(T6)大小的关系为T4< T6 ,则该反应的平衡常数K4_____(填“<”、“=”或“>”) K6。
③若在第7min时增加D的物质的量,A的物质的量变化正确的是 (用图中a、b、 c编号回答)
查看答案和解析>>
科目: 来源: 题型:
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第8项应为:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | …… |
| …… | C2H6 | C5H12 | C8H18 | …… | …… | …… | …… |
A.C36H74 B.C48H98 C.C80H162 D.C106H214
查看答案和解析>>
科目: 来源: 题型:
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是

A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
查看答案和解析>>
科目: 来源: 题型:
向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
C.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
将MgCl2与FeCl3的饱和溶液等体积混合,再加入足量浓NaOH溶液,发生的反应为(已知:20℃时,Mg(OH)2和Fe(OH)3的溶解度分别为:9×10-4g和3×10-9g)
A.只有Fe(OH)3沉淀生成 B.Mg(OH)2和Fe(OH)3沉淀等质量生成
C.Mg(OH)2沉淀少于Fe(OH)3沉淀 D.Mg(OH)2沉淀多于Fe(OH)3沉淀
查看答案和解析>>
科目: 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.IA族与VIIA族元素间可形成共价化合物或离子化合物
B.短周期的元素从左到右,其最高正价均从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目: 来源: 题型:
下列述叙正确的是
A.取一小块铝箔用砂纸打磨除去表面的氧化膜后,在酒精灯上加热灼烧,可看到铝箔燃烧起来火星四溅
B.Mg(OH)2的悬浊液中加入NH4Cl溶液后变澄清,是因为Mg(OH)2的Ksp在NH4Cl溶液中变大
C.将0.01mol/LKMnO4的酸性溶液滴入0.1mol/LH2C2O4溶液中,紫红色褪去的速率会逐渐加快
D.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com