
科目: 来源: 题型:
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
① 请结合上表数据,写出NO与活性炭反应的化学方程式 。
② 上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= ,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96 L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为 ,
所得溶液中离子浓度由大到小的顺序为 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。现将浓度为2×10—4mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为 。
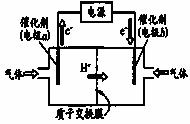
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生
反应为 ,则b电极的电
,则b电极的电
极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
氢溴酸、硫酸钡是用途广泛的工业产品。实验室利用SO2、Br2模拟工业上精制氢溴酸同时得副产品硫酸钡,有关流程如下:
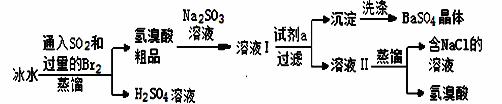
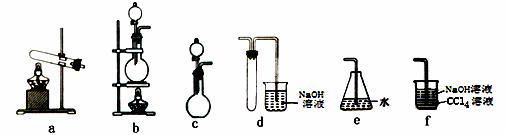
(1)实验室制Br2的反应原理为2NaBr+3H2SO4(浓)+MnO2 2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。
2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。
(2)试剂a为 ,使用冰水的目的是 。
(3)加入Na2SO3的目的是除去 ,所加Na2SO3的量的多少是否会影响氢溴酸的产量? (填“影响”或“不影响”)。
(4)为得到纯净的BaSO4晶体,洗涤沉淀的具体操作为:
。
(5)工业上氢溴酸常显淡黄色,可能的原因是:①含有杂质Fe3+②含有杂质Br2③含有杂质Fe3+、Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是 (填字母)。 a.KMnO4 b.CCl4 c.NaOH d.KSCN
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是 ;元素F在周期表中的位置 。
 (2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(3)C4气态分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,
生成lmol C C放出942KJ热量。试写出由C4气态分子变成C2气态分
C放出942KJ热量。试写出由C4气态分子变成C2气态分
子的热化学方程式 。
(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分
步水解而呈弱酸性。
① 盐x显酸性原因(用离子方程式表示) 。
② 写出足量金属镁加入盐x的溶液中所发生反应的化学方程式
。
(5)E所在周期中原子半径最大的元素与D元素可形成化合物у,酚酞试液遇у先变红后褪色,写出等物质的量的у与FeSO4投入水中恰好完全反应的离子反应方程式
。
查看答案和解析>>
科目: 来源: 题型:
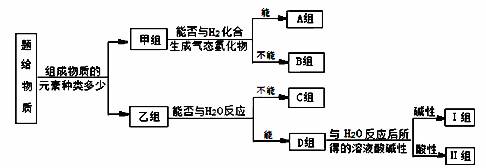
现有 NH3、CO、Na、Na202、Fe、NO、NO2, F2、SO2.SOCl2 等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类
请回答下列问题
(1)图中所示的分类方法叫_______________。
(2)淡黄色固体最终位于_______组,它的电子式为 。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式 。
(4)Ⅱ组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为 。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有_______g该物质参与反应。
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,常用于某些盐的脱水以制取无水盐,写出该物质与AlCl3·6H20反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
常温常压时,下列叙述不正确的是( )
A. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
B.pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②>③
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.0.1 mol/L的醋酸的pH =a,0.01mol/L的醋酸的pH =b,则b<a+l
查看答案和解析>>
科目: 来源: 题型:
关于下列四个图像的说法中正确的是( )
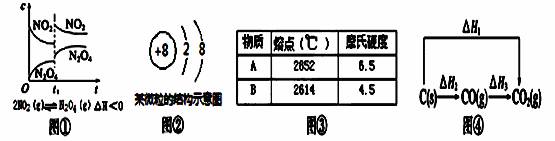
A. 图①t1时改变的条件可能是升高了温度或增大了压强
B. 图②该微粒仅为18O2-不能为16O2-
C. 图③若A为CaO,则B可能为MgO
D. 图④中的ΔH1<ΔH2
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.HIO与HCN均为含有极性键的直线形极性分子
B.SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物
C.Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生
D.明矾与离子交换树脂均能将海水进行淡化
查看答案和解析>>
科目: 来源: 题型:
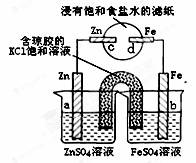
对右图装置说法正确的是( )
A.a电极上发生还原反应
B.盐桥中的阴离子向b电极移动
C.一段时间后,c电极区溶液的pH降低
D.—定时间内,向d电极区滴入黄色K3[Fe(CN)6]溶液,可能出现Fe3[Fe(CN)6]2蓝色沉淀
查看答案和解析>>
科目: 来源: 题型:
下列实验装置设计正确、且能达到目的的是( )
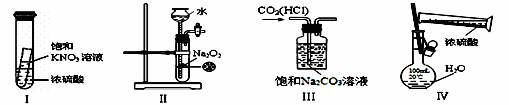
A.实验Ⅰ:静置一段时间,小试管内有晶体析出
B.实验Ⅱ:制取O2
C.实验Ⅲ:除CO2气体中的HCl
D.实验Ⅳ:配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目: 来源: 题型:
下列溶液中离子一定能够大量共存的是( )
A. 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
B. 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
C. c(H+)∶c(OH-)=1∶1012的水溶液中:CO32-、Na+、NO3-、AlO2-
D. 无色溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com