
科目: 来源: 题型:
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |
食盐水 |
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.常温常压下,17g羟基中所含电子数为9NA
B.常温下,1 mol Fe与足量浓硝酸反应,转移2 NA个电子
C.常温常压下,22.4L的NO2 和CO2混合气体含有2 NA 个O 原子
D.在1L0.1 mol/L碳酸钠溶液中,阴离子总数小于0.1 NA
查看答案和解析>>
科目: 来源: 题型:
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
 A.分子中每个原子最外层均达到8电子稳定结构
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中硫元素为-2价磷元素为+3价
C.热化学方程式为P4S3( s)+8O2(g) =P4O10(s )+3SO2(g) △H=-3677kJ/mol
D.一个P4S3分子中含有三个非极性共价键
查看答案和解析>>
科目: 来源: 题型:
“化学是一门中心学科,与社会、生活有密切的关系”。下列叙述中正确的是
A.液化石油气的主要成分是甲烷
B.不锈钢餐具和目前流通的硬币都属于合金
C.医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡
D.制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。

|
| |
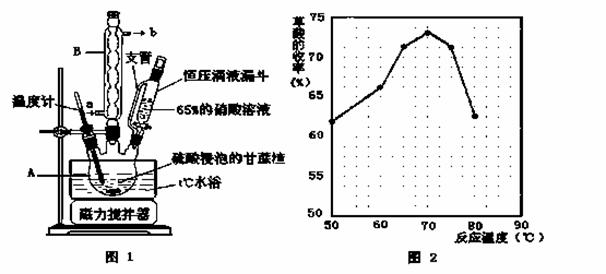
请跟据以上信息回答下列问题:
(1)图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
(2)图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
(3)在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
(4)要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 。
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。
查看答案和解析>>
科目: 来源: 题型:
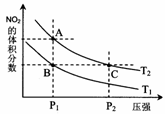
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构
式分别是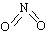 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
 (1)写出N2O4转化为NO2的热化学方程式:
(1)写出N2O4转化为NO2的热化学方程式:
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2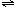 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
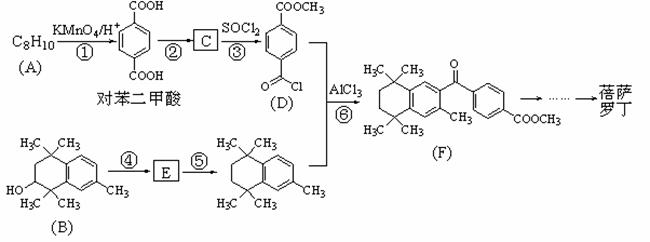
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
已知:Ⅰ. 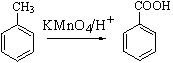 Ⅱ.
Ⅱ.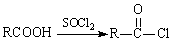
试回答下列问题:
(1) D的分子式为 ; F分子中含氧官能团的名称为 、 。
(2)原料A的结构简式为 ;原料B发生反应④所需的条件为 。
(3)反应①、⑥所属的反应类型分别为 、 。
(4)反应②、⑤的化学方程式分别为②______________;⑤ ______________。
(5)对苯二甲酸有多种同分异构体,符合下列条件的同分异构体有 种,写出其中任意一种的结构简式 。
①苯环上有三个取代基;②能与NaHCO3溶液发生反应;③能发生银镜反应。
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如右图所示。
该电池的负极反应式是___________________________________。
 (4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目: 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和 Cl2反应的产物之一为SO42-。下列说法中,不正确的是( )
A.该反应中氧化剂是Cl2
B.根据该反应可判断还原性:S2O32- > Cl-
C.上述反应中,每生成l mol SO42-,转移4 mol电子
D.SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
查看答案和解析>>
科目: 来源: 题型:
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
A.离子半径:
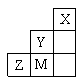 B.Z元素形成的氧化物都是共价化合物
B.Z元素形成的氧化物都是共价化合物
C.气态氢化物稳定性:
D.三种元素中,M的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com