
科目: 来源: 题型:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:
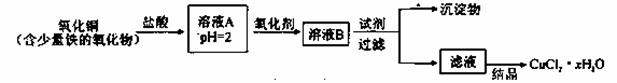
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④ KSCN
(2)氧化剂可选用_________。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。

(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
右图为一原电池的结构示意图,下列说法中,不正确的是
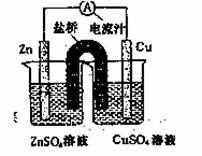
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
B.原电池工作时, Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.盐桥中阳离子流向CuSO4溶液中
查看答案和解析>>
科目: 来源: 题型:
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
A.Fe(NO3)x中的x为2
B.磁性氧化铁中的铁元素全部被氧化
C.稀HNO3在反应中只作氧化剂
D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移
查看答案和解析>>
科目: 来源: 题型:
下列有关热化学方程式书写及对应表述均正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则
Fe(s)+S(s)=FeS(s) △H=-95.6kJ/mol
B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:
2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol
D.已知2C(s)+O2 (g)=2CO(g) △H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/L
查看答案和解析>>
科目: 来源: 题型:
下列比较中,正确的是
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小
D.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是
A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1
B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10S时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g) Z(g)
Z(g)
查看答案和解析>>
科目: 来源: 题型:
下列有关结论中,正确的是
A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低
B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-)
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成
H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成
D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com