
科目: 来源: 题型:
在密闭容器中存在下列平衡:CO(g)+H2O(g)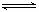 CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
 A.平衡状态A与C相比,平衡状态A的c(CO)小
A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.反应CO(g)+H2O(g)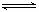 CO2(g)+H2(g)
CO2(g)+H2(g)
△H>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系(未注明反应条件),下列说法不正确的是
 A.若X为金属单质,Y为非金属固体单质,则Z为O2
A.若X为金属单质,Y为非金属固体单质,则Z为O2
B.若X、Y均为金属单质,则甲不可能为黑色固体
C.若X为金属单质,Y为非金属气体单质,则乙可能为黑色固体
D.若X、Y均为非金属固体单质,则Z可能为O2
查看答案和解析>>
科目: 来源: 题型:
设阿伏加德罗常数为NA,下列说法正确的是
A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA
B.1mol NH3含有的电子数10NA
C.常温常压下,22.4 L的氧气含氧原子数为2NA
D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组设计以下实验方案,可从样品中提取粗产品:

下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维
C.二氧化硫是一种有毒气体,所以不能用于杀菌消毒
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目: 来源: 题型:
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为___________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为___________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于___________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为___________,中心原子杂化类型为___________。
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为___________(填序号)。
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式__________ 。
查看答案和解析>>
科目: 来源: 题型:
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为___________。
(2)Fe元素位于周期表的___________区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___________和______(填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有___________。
(4)根据VSEPR理论预测ED4-离子的空间构型为___________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为___________ (写2种)。
查看答案和解析>>
科目: 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
 ②有关有机物的沸点:
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是______________________。若反应前向D中加入几
(3)滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________;反应结束后D中的现象是__________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________。
查看答案和解析>>
科目: 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。
则S(s)+3F2(g)=SF6(g)的反应热△H为 ( )
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com