
科目: 来源: 题型:
下列说法正确的是
A.直馏汽油和裂化汽油中分别加入溴的四氯化碳溶液均能发生反应
B.有机物中一定含有C、H元素,可能含有氧、氮元素及卤素等
C.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
D.石油主要含有C、H两种元素,石油分馏得到的各馏分均是混合物
查看答案和解析>>
科目: 来源: 题型:
将高科技用于现代战争,是备受军事专家关注的焦点,让雷达无法侦察到的隐形飞机一直受到全世界的极大关注.用于制造隐形飞机的物质A 具有吸收微波的功能,其主要成分的结构如图,关于该物质的说法正确的是
A.该物质属于无机物 B.该物质是一种芳香烃
C.该物质不可能使溴水褪色 D.该物质最多可与3molH2发生加成反应

查看答案和解析>>
科目: 来源: 题型:
(化学——选修有机化学基础)(15分)
研究表明,火灾中,真正烧死的人其实并不多,大多数人都是因慌乱奔跑时吸入大量浓烟,导致烟雾中毒而死的。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯(PVC)是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

请回答下列问题:
⑴火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,①~③的反应类型是 。
在火灾现场,为防止气体中毒的防护措施是 。
⑵工业上用乙烯和氯气为原料经下列各步合成PVC:
 |  |  |
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、②的化学方程式分别为 、 。
⑶聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标
准的增塑剂DEHA。 邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
邻苯二甲酸辛酯(DOP)是国家标准中允许使用的
增塑剂之一,邻苯二甲酸酐( )是制造DOP的原料,它跟过
量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
。
查看答案和解析>>
科目: 来源: 题型:
【化学——物质结构与性质】(15分)
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 。
⑸与铜同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
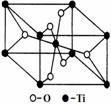
⑹在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中
金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
查看答案和解析>>
科目: 来源: 题型:
【化学——化学与技术】(15分)
 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为
1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I ”中加KOH固体的目的是① ,
② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
查看答案和解析>>
科目: 来源: 题型:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
① 将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
② 将一定量的淀粉水解液加入三颈烧瓶中;
③ 控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④ 反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是 。
(3)装置B的作用是 。为使尾气充分吸收,C中试剂是 。
(4)重结晶时,将草酸晶体粗品经①加热溶解、②趁热过滤、③冷却结晶、④过滤洗涤⑤干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在 (填上述步骤序号)时除去;而粗品中溶解度较小的杂质最后留存在 (填“滤纸上”或“滤液中”)。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
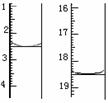 称取该样品0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
称取该样品0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据右图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据右图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
图1 图2 图3
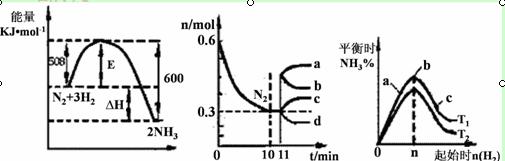
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
②图3 中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0 若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
0 若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) 已知该反应的△H 0,简述该设想能否实现的依据: 。
0,简述该设想能否实现的依据: 。

查看答案和解析>>
科目: 来源: 题型:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为
(2)工业上生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
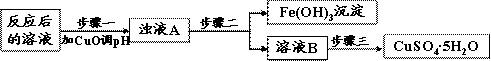 |
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
步骤一应调节溶液的pH范围是 ,请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
 ②步骤三中的具体操作方法是
②步骤三中的具体操作方法是
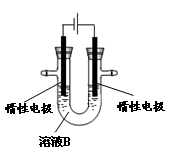
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是 ,若装入B溶液500mL(电解前后溶液体积变化可忽略),当阴极增重1.6g时,停止通电,则反应后溶液的pH= 。
(4)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH
已知:①2Cu(s)+1/2O2(g)=Cu2O(s) ΔH=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s) ΔH=-79.5kJ/mol
③S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
则该法冶炼铜的反应中ΔH= 。
查看答案和解析>>
科目: 来源: 题型:
在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g 铜粉,充分反应后产生的气体在标准状况下的体积为2.24L,则x值至少为
A 0.1 B 0.15 C 0.12 D 0.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com