
科目: 来源: 题型:
以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下:

回答下列问题:
电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为: 氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为: _______________________________________________________________ 该流程中加入活性炭的作用是
碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
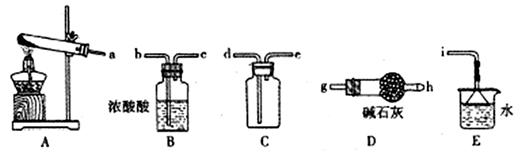
如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)
 副产品A的化学式为 。
副产品A的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)→NH2CO2 NH4(s) +l59.5 kJ·mol-1
②NH2CO2NH4(s) →CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
③H2O(1) →H2O(g) -44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
科目: 来源: 题型:
在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2+ + 2NH3·H2O → Fe(OH)2↓+ 2NH4+ 和 _________ 。(化学方程式)
查看答案和解析>>
科目: 来源: 题型:
某同学设计了两种方案制备氢氧化铝。
方案一:2.7 g Al X溶液
X溶液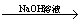 Al(OH)3沉淀
Al(OH)3沉淀
方案二:2.7 g Al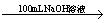 Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
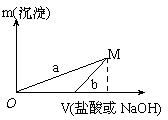 已知所用的稀盐酸与NaOH溶液均为3mol/L。右图是向
已知所用的稀盐酸与NaOH溶液均为3mol/L。右图是向
X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生
沉淀的质量与加入溶液体积之间的关系。相关说法正确的是
A.a曲线表示的是向X溶液中加入NaOH溶液
B.在M点时,两种方案中所得溶液的溶质质量分数相同
C.方案二比方案一生成更多的气体
D.M点以后,a、b两条曲线将重合为一条
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com