
科目: 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
A.与铜质水龙头连接处的钢质水管易发生腐蚀
B.明矾常作为净水剂,双氧水通常可用于作杀菌消毒
C.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜
D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器灭火
查看答案和解析>>
科目: 来源: 题型:
一定温度下,密闭容器中M、N、R三种气体的初始浓度和平衡浓度如下表所示:
| 物质 | M | N | R |
| 初始浓度/mol•L—1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol•L—1 | 0.02 | 0.21 | 0.18 |
(1)请通过计算写出此反应的化学方程式。
(2)达平衡时,N的转化率是多少?
(3)该温度下的平衡常数
查看答案和解析>>
科目: 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ —— Mn2+ + CO2↑+ H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| A | 2 mL | 20 | |
| B | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| C | 2 mL | 30 | |
| D | 1 mL | 20 | V1 mL蒸馏水 |
| E | 0.5 mL | 20 | V2 mL蒸馏水 |
(1)完成上述实验方案设计,其中: V1= ,V2= ;
(2) 如果研究温度对化学反应速率的影响,使用实验 和 。
(3) 甲同学在做A组实验时,发现反应开始时速率较慢,随后加快。他分析认为高锰酸钾与
草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,
你猜想还可能是 ;
Ⅱ.乙同学利用下图测定反应速率

回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 仪来记录数据。
查看答案和解析>>
科目: 来源: 题型:
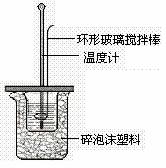 已知测定中和热的实验步骤如下:①量取30mL 0.5 mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5 mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。回答下列问题
(1)硫酸溶液稍过量的原因 。
(2)需要测定 个数据,加入NaOH溶液的正确操作是
,使硫酸与氢氧化钠溶液混合均匀的正确操作是 。
(3)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,实验前后温度差平均值是△t,请根据实验数据求出中和热为 ,写出该反应的热化学方程式_________ 。
查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为 反应(选填“吸热”、“放热”),该反应平衡常数表达式为 ;
(2)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、
2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 。(选填“正反应方向”、“逆反应方向”、“不移动”)
查看答案和解析>>
科目: 来源: 题型:
(1)甲醇是一种优质燃料,可制作燃料电池。
①工业上可用下列两种反应制备甲醇:
 CO(g) + 2H2(g)
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g)+3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3
则2CO(g)+O2(g) =2CO2(g) 的反应热ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
②生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”);
(2)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)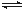 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
计算反应上述反应的焓变△H=_____________。
(3)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol
请回答下列问题:
①生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“大于”、“小于”或“等于”)
(4)已知:
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=—890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=—566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的________倍(计算结果保留1位小数)。
(5)已知热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g);△H=+765.2 kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H=+765.2 kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
查看答案和解析>>
科目: 来源: 题型:
化学反应N2+3H2  2NH3的能量变化如图所示(△E>0),该反应的热化学方程式是
2NH3的能量变化如图所示(△E>0),该反应的热化学方程式是
A.N2(g)+3H2(g) 2NH3(l)
2NH3(l)
ΔH=-2(b+c - a)kJ/mol
B.N2(g)+3H2(g) 2NH3(g)
2NH3(g)
ΔH =-2(a - b)kJ/mol
C.N2(g)+3H2(g)  2NH3(l)
2NH3(l)
ΔH=+(b+c - a)kJ/mol
D.N2(g)+3H2(g)  2NH3(g) ΔH=+(a+b)kJ/mol
2NH3(g) ΔH=+(a+b)kJ/mol
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质B的质量分数增加了
C.物质A的转化率减少了 D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com