
科目: 来源: 题型:
下列存在丁达尔现象的分散系是( )
①有尘埃的空气 ②溴水 ③蒸馏水 ④沸水中加入适量饱和FeCl3的溶液至溶液变为透明的红褐色液体 ⑤淀粉的溶液
A.①②③⑤ B.①④⑤ C.②③ D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1KNO3溶液:H+,Fe2+,Cl-,SO4 2-
B.石蕊溶液呈红色的溶液:NH4+,Ba2+,AlO2-,Cl—
C.与铝反应产生大量氢气的溶液:Na+,K+,NH4+,NO3-
D.pH=12的溶液:K+,Na+,NO3—,Cl—
查看答案和解析>>
科目: 来源: 题型:
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3==N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目: 来源: 题型:
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.同周期的主族元素中,ⅦA族元素的原子半径最小
B.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱
C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素
D.ⅠA元素的原子,其半径越大,越容易失去电子
查看答案和解析>>
科目: 来源: 题型:
下列混合物的分离方法不正确的是( )
A.水和汽油的混合物用分液方法分离
B.石灰水中悬浮的固体碳酸钙用过滤方法分离
C.碘水中的碘用酒精萃取分离
D.乙醇中溶解微量食盐,用蒸馏方法分离
查看答案和解析>>
科目: 来源: 题型:
化合物ICl电子式 ,其中I的化合价为 ,你判断I化合价依据是 ,预测ICl与H2O反应的化学方程式为 。你预测反应正确与否的实验依据是
(提示:AgI为黄色沉淀)该反应 (填是/不是)氧化还原反应。次碘酸的电子式 。
(2)写出任意一种由多个原子组成的含有与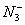 电子数相同的微粒的化学式 。
电子数相同的微粒的化学式 。
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z、U、V 、W是短周期内的六种元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Y元素的一种同素异形体在自然界中硬度最大,U、Z在元素周期表中处于相邻位置,它们的单质在常温下均为无色气体,V元素原子半径在短周期元素原子半径中最大,W元素的最高正价与最低负价的代数和为4。
(1)请写出W原子的结构示意图 ;
(2)W单质与Z单质的反应产物在一定条件下与Z单质反应,该反应的化学方程式: 。
(3)X、Y、Z、W四种元素组成原子个数比为:8:2:4:1的化合物,该化合物的化学式为 。
(4)Z元素的最高价氧化物对应的水化物与Z元素的氢化物可以反应,写出该反应的的化学方程式 。
(5)写出Y的最高价氧化物的结构式 。
(6)写出Z、V形成的原子个最比为1:1的化合物的电子式 。
(7)指出Y、Z、U形成氢化物的稳定性由弱到强的顺序: 。
(用化学式表示)
查看答案和解析>>
科目: 来源: 题型:
根据下列要求回答相关问题:
(1)下列物质沸点递变顺序正确的是 (填字母,下同)。
A.SnH4>GeH4>SiH4>CH4 B.SbH3>AsH3>PH3>NH3
C.HI>HBr>HCl>HF D.H2Te>H2Se>H2S>H2O
(2)下列过程中:①冰融化成水;②HNO3溶于水;③NH4Cl受热分解。依次克服作用力的类型分别是 。
A.氢键、范德华力、离子键 B.氢键、极性键、离子键
C.范德华力、氢键、非极性键 D.范德华力、非极性键、极性键
(3)下列说法正确的是 。
A.氨、氯化氢与水分子都能形成氢键,故它们极易溶于水
B.由于氢键存在,卤化氢中HF最稳定
C.冰的密度小于水的密度,是由于水分子间存在氢键
D.NH3、H2O、HF相对分子质量依次增大,沸点依次升高
查看答案和解析>>
科目: 来源: 题型:
在氢、氮、氯和钠四种元素中:
(1)有2种元素组成的共价化合物的水溶液显酸性,这种化合物的电子式是
;
(2)有2种元素可形成离子化合物,用子电式表示其形成过程:
;
(3)在它们可能形成的双原子分子的单质中,化学性质最稳定的是:
。(写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com