
科目: 来源:不详 题型:填空题
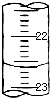
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:单选题
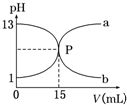
| A.盐酸的物质的量浓度为1 mol/L |
| B.酚酞不能作本实验的指示剂 |
| C.曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D.P点时反应恰好完全,溶液呈中性 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
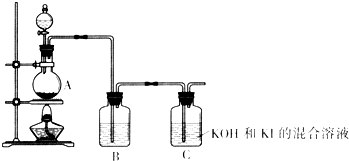
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 次数 | V(NaOH)/mL | V(HCl)/mL |
| 1 | 20.48 | 22.46 |
| 2 | 25.00 | 21.98 |
| 3 | 25.00 | 22.36 |
| 次数 | V(NaOH)/mL | V(HCl)/mL | ||||
| 始读数V1 | 终读数V2 | V2-V1 | 始读数V1′ | 终读数V2′ | V2′-V1′ | |
| 1 | 0.10 | 25.00 | 0.00 | 24.80 | ||
| 2 | 0.00 | 24.80 | 0.10 | 22.32 | ||
| 3 | 0.00 | 24.80 | 0.00 | 24.70 | ||
| △ |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.4 |
| 第二次 | 10.00 | 4.00 | 24.1 |
查看答案和解析>>
科目: 来源:天津期中题 题型:实验题
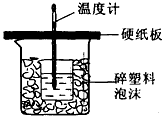
查看答案和解析>>
科目: 来源:0110 期中题 题型:实验题
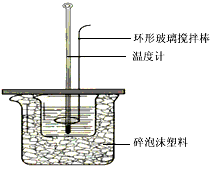
查看答案和解析>>
科目: 来源:0119 期中题 题型:填空题
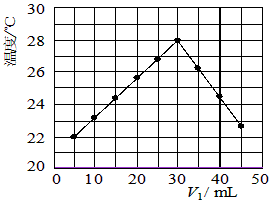
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com