
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
关于下列装置说法正确的是
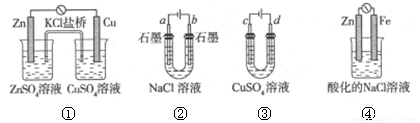
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.滴有酚酞溶液的装置②在电解过程中,b极先变红
C.可以用装置③在铁上镀铜,d极为铜
D.装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
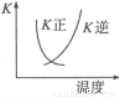
B. 的正、逆反应的平衡常数K随温度的变化可用上图表示
的正、逆反应的平衡常数K随温度的变化可用上图表示
C.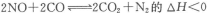 ,常温下该反应一定能自发进行
,常温下该反应一定能自发进行
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
已知反应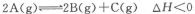 ,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
A.减小容器容积 B.增大容器容积
C.减小B的浓度 D.降温
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:
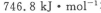 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0. 1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
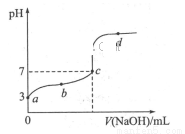
A.a点表示溶液中c(CH3COO-)约为10 mol/L
mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中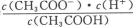 大于K
大于K
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
可以证明可逆反应 已达到平衡状态的是
已达到平衡状态的是
①一个N N键断裂的同时,有6个N-H键断裂
N键断裂的同时,有6个N-H键断裂
②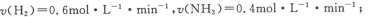
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变;
A.②③④ B.①②④
C.①③④ D.③④⑤
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是
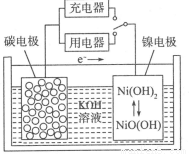
A.充电时,阴极的电极反应为: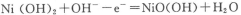
B.放电时,负极的电极反应为: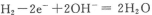
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:填空题
(12分)甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为: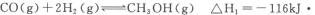
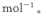
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是_____。
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知: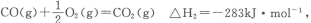
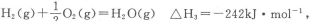
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________________.
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:
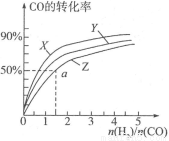
①在图中三条曲线,对应的温度由高到低的顺序是__________________;
②利用a点对应的数据,计算出曲线Z在对应温度下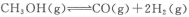 的平衡常数:K=______;
的平衡常数:K=______;
(4)恒温下,分别将1 molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应。
①达到平衡所需时间是I _____Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是I_____Ⅱ。
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为______。
查看答案和解析>>
科目: 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:填空题
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
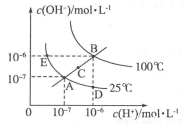
(1)图中A、B、C、D四点的 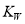 由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com