
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
下列实验方案不能证明醋酸是弱电解质的是
A.往0.10 mol/L CH3COOH溶液中加CH3COONa固体,pH增大
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,两者的pH相差小于1个单位。
C.对盐酸和醋酸溶液进行导电性实验,与CH3COOH溶液相串联的灯泡较暗。
D.室温,PH=3的醋酸与PH=11的NaOH溶液等体积混合,溶液PH<7。
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的NO2的体积分数:C > A
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若p2 > p1,则化学平衡常数KA > KC
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各组离子一定能大量共存的是
A.由水电离出的c(H+)=1×10-14mol/L的溶液中: K+、I-、Cl-、NO3-
B.在呈中性的溶液中:Al3+、Na+、CO32—、Cl—
C.在pH=12的溶液中 NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1 mol·L-1的溶液中Fe3+、K+、Cl-、NO3-
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象可能出现的是
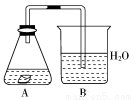
A.B中导气管中产生气泡 B.B中导气管里形成一段水柱
C.锥形瓶中溶液无色 D.铁被腐蚀
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
某二元酸H2A在水中发生电离:H2A=H++HA-,HA- H++A2-。下列叙述中不正确的是
H++A2-。下列叙述中不正确的是
A.在NaHA溶液中c(Na+)>c (HA-)> c(H+) >c (OH-)
B.在Na2A溶液中c (Na+)=2c (A2-)+2c(HA-)+2c (H2A)
C.在Na2A溶液中 c (OH-) =c (HA-)+ c (H+)
D.在H2A溶液中c (H+)=c (HA-)+2c (A2-)+c (OH-)
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是
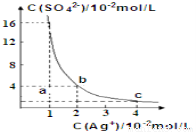
A.含有大量SO42-的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数(Ksp)为8×10-4
C.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D.0.02molL-1的AgNO3溶液与0.2molL-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,浓度均为0.1mol·L-1 的三种溶液:①CH3COOH 溶液 ②NaOH 溶液 ③CH3COONa溶液。下列说法不正确的是
A.溶液的pH :②>③>①
B.水电离出的c(OH- ):③>①>②
C.①和③等体积混合后的溶液:c(H+)+c(CH3COOH) =c(OH- )+c(CH3COO-)
D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol·L-1
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
下列图示与对应叙述相符合的是

A.图I:反应CO+NO2 CO2+NO达平衡后,升高温度时反应速率随时间的变化
CO2+NO达平衡后,升高温度时反应速率随时间的变化
B.图Ⅱ:反应2SO2+O2 2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
C.图Ⅲ:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系
2NH3在恒温情况下,反应速率与压强的关系
D.图Ⅳ:反应CO2(g)+H2(g) CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[
CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
A.混合溶液可能显示酸性、碱性或中性
B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O)
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为 mol·L-1
mol·L-1
查看答案和解析>>
科目: 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:填空题
(12分)(1)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)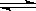 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2 。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com