
科目: 来源:海南省期末题 题型:实验题
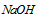 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度: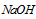 溶液所需的玻璃仪器为____________________。
溶液所需的玻璃仪器为____________________。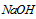 溶液滴定到终点。该同学进行了三次实验,实验数据如下表
溶液滴定到终点。该同学进行了三次实验,实验数据如下表
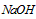 溶液前未润洗
溶液前未润洗 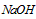 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡 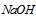 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡 查看答案和解析>>
科目: 来源:0117 期中题 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
实验编号 |
待测盐酸溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
| ① |
25.00 |
0.00 |
23.80 |
② |
25.00 |
1.00 |
24.78 |
| ③ |
25.00 |
0.22 |
24.04 |

查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.配制标准溶液的固体KOH中混有NaOH杂质 |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目: 来源:不详 题型:问答题

查看答案和解析>>
科目: 来源:不详 题型:问答题

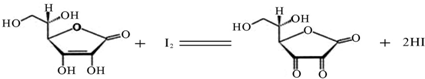

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.使用滴定管时,洗涤后必须用待装液润洗2~3次 |
| B.盛装准确量取的待测液的锥形瓶用待测液润洗2~3次 |
| C.酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液 |
| D.滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |

| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少)______ |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | ______ |
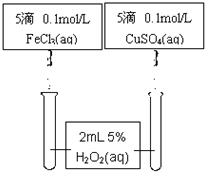
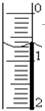
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com