
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.a=20.00 |
| B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) |
| C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00 |
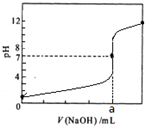
查看答案和解析>>
科目: 来源:不详 题型:填空题
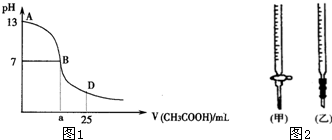
| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
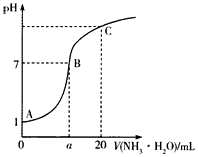
| A.①③②④⑤⑥ | B.①②③④⑤⑥ | C.②③①④⑤⑥ | D.④⑤①②③⑥ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.以酚酞作指示剂 |
| B.锥形瓶沾有少量水 |
| C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D.滴定前仰视滴定管读数,滴定后平视刻度读数 |
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
查看答案和解析>>
科目: 来源:0127 期末题 题型:实验题
查看答案和解析>>
科目: 来源:期末题 题型:实验题
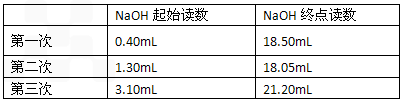
查看答案和解析>>
科目: 来源:0105 期末题 题型:实验题
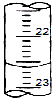
查看答案和解析>>
科目: 来源:0114 期中题 题型:填空题
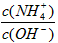 的值将_________(填“变小”,“变大”或“不变”);
的值将_________(填“变小”,“变大”或“不变”); 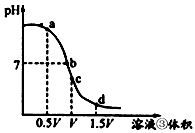
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com