
科目: 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:实验题
(13分)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60 ℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
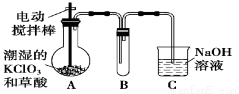
(1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、__________。
(2)B装置必须放在冰水浴中,其原因是______________________________。
(3)反应后在装置C中可得NaClO2溶液。已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。NaClO2的溶解度曲线如图
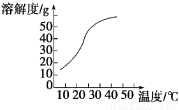
获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③ ;
④在55℃干燥,得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样,量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V2 mL(已知2Na2S2O3+I2===Na2S4O6+2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:_______。
②若步骤2所得溶液放置时间太长,则测定结果____________(填“偏高”、“偏低”或“不变”)
③ClO2溶液的浓度为________ g·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:推断题
(16分)有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
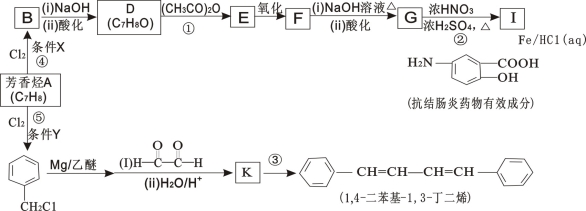
已知:
Ⅰ.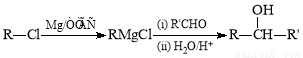 (R、R`表示烃基)
(R、R`表示烃基)
Ⅱ.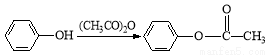
Ⅲ.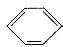
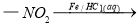

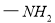
Ⅳ.

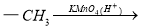

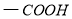
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是 。
(2)D的结构简式是_______________
(3)写出F与NaOH反应的化学方程式 。
(4)下列说法正确的是________(填选项字母)。
A.④的反应条件X和⑤的反应条件Y完全相同
B.①②④⑤反应类型相同
C.G不可以发生缩聚反应
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化
(5)检验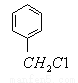 有氯原子的方法是 。
有氯原子的方法是 。
(6)③的化学方程式是 。
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式: 。
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3∶2∶2
查看答案和解析>>
科目: 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:简答题
(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH=+8. 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH=+90. 4 kJ·mol-1 |
方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
|
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
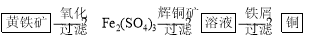
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.用饱和硫酸铵溶液沉淀蛋白质
B.用生石灰干燥氨气
C.用铝制的容器盛装浓硫酸
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是
A.C2H4分子中所有原子共平面 B.C2H4既作氧化剂,又作还原剂
C.HCN分子中既含σ键又含π键 D.转移0.2mol电子,生成2.24L H2
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是
A.该溶液中,Na+、H+、Cl-、NO3-可以大量共存
B.和新制氯水反应的离子方程式:Fe2++Cl2=Fe3++2Cl-
C.加入NaOH溶液至Fe2+刚好沉淀完全的离子方程式: Fe2++2OH-=Fe(OH)2↓
D.离子浓度关系:c(SO42-) = c(NH4+ )>c(Fe2+ )>c(H+ )>c(OH-)
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,N表示粒子数。下列说法正确的是
A.0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA
B.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA—N(Cl2)]
C.一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA
D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是
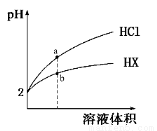
A.稀释前,c(HX)=0.01 mol/L B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-) D.溶液的导电性:a>b
查看答案和解析>>
科目: 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
n(CO) | n(H2O) | n(CO2) | n(H2) | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L·min)
B.容器③中,开始时υ(CO)生成>υ(CO)消耗
C.达平衡过程体系能量的变化:Q1=4Q2
D.平衡时,①与②容器中CO的体积分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com