
科目: 来源: 题型:
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
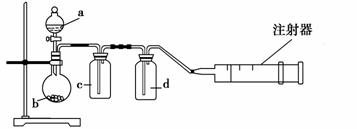
| 选 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
科目: 来源: 题型:
利用下列实验装置不能完成相应实验的是 ( )。
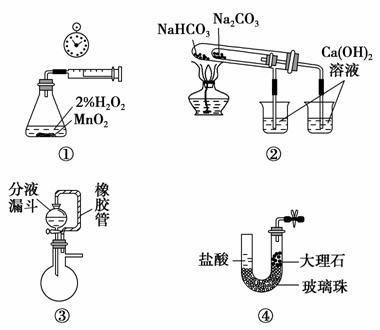
A.用装置①测量生成 氧气的化学反应速率
氧气的化学反应速率
B.用装置②比较NaHCO3和Na2CO3的热稳定性
C.装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D.装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目: 来源: 题型:
下列有关实验原理或实验操作的叙述正确的是 ( )。
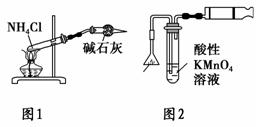 [
[
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上
称量
B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置检验火柴头燃烧 产生的SO2
产生的SO2
查看答案和解析>>
科目: 来源: 题型:
用如图所示装置进行下列实验,能达到实验目的的是 ( )。
A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B.从B口进气,用排空气法收集CO2
C.瓶中盛满水,从B口进气,用排水法收集NO2
D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量 生成H2的体积

查看答案和解析>>
科目: 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流
|
|
|
| |||||||||||
 | |||||||||||
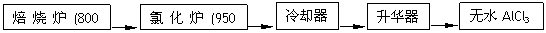 | |||||||||||
|
|
|
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是: ▲ 晶体,其结构式为: ▲ 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 ▲ 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: ▲ 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: ▲ 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+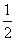 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+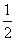 O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: ▲ 。
该反应的平衡常数表达式为K= ▲ 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 ▲ (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
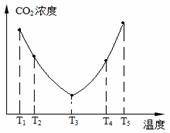 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度
T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充
入一定量的CO2气体(用氮气作为稀释剂),在t时刻,
测得容器中CO2气体的浓度。然后分别在温度为T2、T3、
|
经过相同时间测得CO2气体浓度,其关系如图7,则:
①ΔH3 ▲ 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: ▲ 。



 (3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
 ①催化反硝化法中,用H2将NO
①催化反硝化法中,用H2将NO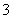 还原为N2,一段时间后,
还原为N2,一段时间后,
溶液的碱性明显增强。则反应离子方程式为: ▲ 。
|
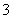 的原理如图8,电源正极为: ▲
的原理如图8,电源正极为: ▲ (选填填“A”或“B”),阴极反应式为: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
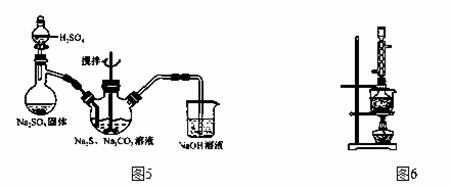
(1)用图5所示装置制取Na2S2O3,其中NaOH溶液的作用是 ▲ 。如将分液漏斗中的H2SO4
改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 ▲ (填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反
应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: ▲ 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 ▲ 作
指示剂,滴定终点的现象是 ▲ 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的
质量分数会 ▲ (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图6所示的装置可将工业级的Na2S提纯。已知Na2S
常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图6所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ▲ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目: 来源: 题型:
从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: ▲ 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1
可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ ▲ mol·L−1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子材料。
|
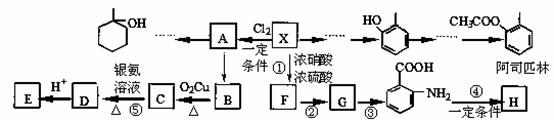
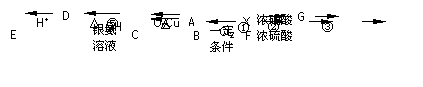
已知: (苯胺,易被氧化)
(苯胺,易被氧化)
|
|
|
|
|
|





(1)X的结构简式: ▲ ,反应⑤的类型: ▲ 。
(2)E中官能团的名称: ▲ 。
(3)反应②③两步能否互换 ▲ ,(填“能”或“不能”)理由是: ▲ 。
(4)反应④的化学方程式是: ▲ 。
(5)写出同时满足下列条件的阿司匹林的一种同分异构体的结构简式: ▲ 。
①苯环上一卤代物只有2种;
②能发生银镜反应,分子中无甲基;
③1mol该物质最多能与3molNaOH反应。
 (6)根据已有知识并结合相关信息,写出以A为原料制备
(6)根据已有知识并结合相关信息,写出以A为原料制备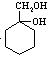 的合成路线流程图(无机试剂任用)。合成路线流程图示例如:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如:
▲ 。
查看答案和解析>>
科目: 来源: 题型:
CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:


已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是: ▲ 。
写出反应Ⅰ中主要反应的离子方程式: ▲ 。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、 ▲ 。
(3)反应Ⅱ中的离子方程式: ▲ 。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为:
▲ ,若pH过大,则可能发生副反应的离子方程式: ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com