
科目: 来源: 题型:
下列说法正确的是
A.蒸干碳酸钾溶液得到的固体物质为KOH
B.铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连
C.工业合成氨反应温度选择700 K左右,可使催化剂活性最强并提高原料利用率
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=2×283.0kJ/mol
查看答案和解析>>
科目: 来源: 题型:
一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量 B.反应后溶液中c(A-)= c(M+)
C.生成的盐发生水解 D.混合前酸与碱中溶质的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA
B.1mol/LFeCl3 溶液中所含Fe3+的数目小于NA
C.常温下,1L pH=12的Ba(OH)2 溶液中含OH—的数目为2NA
D.23g NO2和N2O4的混合气体中含有氮原子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.小苏打溶液与AlCl3溶液混合产生气体和沉淀
C.加热稀醋酸溶液其pH 稍有减小 D.浓的硫化钠溶液有臭味
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.在水中能电离出离子的化合物一定是离子化合物
B.CO2分子中含极性键,且溶于水能导电,所以CO2是电解质
C.Ca(OH)2微溶于水,所以是弱电解质
D.CH3COOH在水中只能部分电离,所以是弱电解质
查看答案和解析>>
科目: 来源: 题型:
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g) + 2B(s)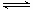 yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压 ②增大A的浓度 ③增大C的量
④升温 ⑤降温 ⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广
泛。铁还有很多的化合物及其化学反应,如铁与水的反应:
3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g) △H
Fe3O4(s) + 4H2(g) △H
(1)已知:① 3Fe(s) + 2O2(g) Fe3O4(s) △H1=-1118.4 kJ/mol
Fe3O4(s) △H1=-1118.4 kJ/mol
② 2H2(g) + O2(g) 2H2O(g) △H2=-483.8 kJ/mol
2H2O(g) △H2=-483.8 kJ/mol
③ 2H2(g) + O2(g) 2H2O(l) △H3=-571.8 kJ/mol
2H2O(l) △H3=-571.8 kJ/mol
则△H =____________________(计算结果保留一位小数)。
(2)在t ℃时,该反应的平衡常数K=16,在2 L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,在t ℃时反应经过一段时间后达到平衡。
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为____________(结果保留一位小数)
②下列说法正确的是______________(填字母序号)
A. 若容器压强恒定,则反应达到平衡状态
B. 若容器内密度恒定,则反应达到平衡状态
C. 甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D. 增加Fe3O4就能提高H2O的转化率
(3)若将(3)中装置改为恒容绝热(不与外界交换能量)的装置,按下表
充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见下表:
|
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列:___________________(用A、B、C表示)。
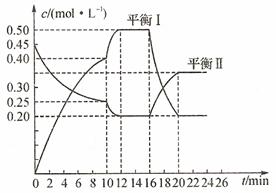
(4)一种以甲醇做燃料的电池示意图如下图。写出该电池放电时负极的电极反应式:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10—5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L的HSCN溶液
分别与0.10 mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积V
与时间t的关系如图甲所示:


反应开始时,两种溶液产生CO2的速率明显不同的原因是____________
_________________________________________________;反应结束后所得溶液中c(SCN—)______c(CH3COO—) (填“>”、“=”或“<”)。
(2)2.0×10—3 mol/L的HF水溶液中,调节溶液pH(忽略调节pH时溶液的
体积变化),测得平衡体系中c(F—)、c(HF)与溶液pH的关系如图乙所示。
则25℃时,HF电离平衡常数为Ka(HF)=_____________________________
______________________(列式并求值,不写单位)。
(3)难溶物CaF2溶度积常数(Ksp)= 1.5×10—10,将4.0×10—4mol/L的HF溶液
与4.0×10—4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节
pH时溶液的体积变化),试分析混合后是否有沉淀生成?________(填“有”
或“没有”),简述理由:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验。填写下列空白:
 实验I:制取次氯酸钠溶液
实验I:制取次氯酸钠溶液
用石墨作电极电解饱和食盐水制取次氯酸钠溶液,设计
右图所示装置进行实验。
(1)电源中,a电极名称是__________。
(2)反应时,生成次氯酸钠的离子方程式为
__________________________________________。
实验II:测定含氰废水处理百分率
利用下图所示装置进行实验。将CN—的浓度为0.2 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
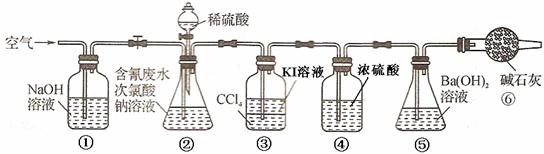
已知装置②中发生的主要反应依次为:
CN— + ClO— = CNO— + Cl—,
2CNO— + 2H+ + 3ClO— = N2↑ + 2CO2↑ + 3Cl— + H2O。
(3)①和⑥的作用是_______________________________________________。
(4)装置②中,生成需由装置③除去的物质的离子方程式为:
______________________________________________________.
(5)反应结束后,缓缓通入空气的目的是_____________________________
_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
I.(10分)四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中
信息回答下列问题。
| X | Y | Z | W | |
| 结构 或 性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)用电子式表示X的氢化物的形成过程_____________________________。
(2)W元素在周期表中的位置为____________________。
(3)上述元素的最高价氧化物对应的水化物中,有一种物质甲与其它三种物质在一定条件下均能发生化学反应,则甲中所含的化学键有________(填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.比较两种元素在化合物中化合价的高低
b.测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
II.(8分)多种物质的转化关系如下图所示(部分反应物或产物已略去,反应条件未列出):
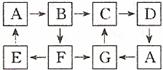
已知:①A、B、C、D、G含有同种元素,且它们的状态与颜色如下表
所示:
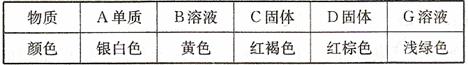
②E是通常情况下密度最小的气体;B与AgNO3生成不溶于稀硝酸的白色沉淀;一种气体氧化物M通入B溶液中可被氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。
请回答下列问题:
(1)写出下列物质的化学式:D___________;E__________。
(2)写出下列反应的离子方程式:
①B+M→F:________________________________________;
②A+F→E+G:______________________________________。
(3)下列氧化物中能与G溶液反应直接生成C固体的是_______(填字母)。
a.Na2O2 b.SO2 c.CO2 d.BaO2
查看答案和解析>>
科目: 来源: 题型:
下列叙述与对应图像或数据描述正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱
性最强
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径最高或最低化合价 | 0.74 | 1.60 +2 | 1.52 +1 | 1.10 +5 | 0.99 +7 | 1.86 +1 | 0.75 +5 | 0.82 +3 |
| —2 | —3 | —1 | —3 |
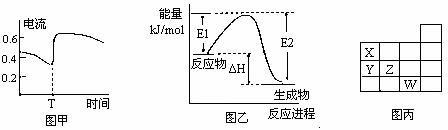
B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
D.图丙表示周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com