
科目: 来源: 题型:
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、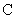 等杂质。某同学设计了 如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3,的质量分数(忽略NH3在强碱性溶液中的溶解)。
等杂质。某同学设计了 如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3,的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为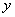
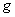 ,滴定管的读数为
,滴定管的读数为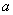 mL。
mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 (填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为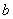 mL,称得D装置的质量为
mL,称得D装置的质量为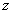
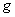 ,
,
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 __________(填“偏大”、“偏小”或“无影响”)。
③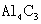 的质量分数为 ___________。(该实验条件下的气体摩尔体积为
的质量分数为 ___________。(该实验条件下的气体摩尔体积为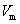 )。
)。
查看答案和解析>>
科目: 来源: 题型:
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:

通过________可以检验流程中滤液2中含有Na+,该实验的具体操作是
。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO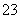 )=0.50 mol/L,c(HCO
)=0.50 mol/L,c(HCO )=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
)=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO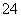 ,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为: ___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)日常生活中常用的“84消毒液”的主要成分是NaClO,消毒液呈碱性的原因是
(用离子方程式表示);将1mol/L的NaClO溶液和0.5mol/L的FeCl2等体积混合时,反应的离子方程式为 。
(4)Mg-H2O2酸性电池采用海水作电解质溶液(加入一定量的稀硫酸),该电池的正极的反应式为______________________________________。放电时正极附近溶液的PH________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________________________________,又变为棕黄色的原因是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,下列叙述不正确的是( )
A.气体甲中SO2与H2的体积比为4:1
B.反应中共消耗1.8 mol H2SO4
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
查看答案和解析>>
科目: 来源: 题型:
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示。下列叙述中正确的是( )
A.该物质的分子式为C20H30O
B.该物质能与NaHCO3溶液反应
C.能使溴的四氯化碳溶液褪色
D.该物质分子中的所有碳原子均共面
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是 ( )
2Z(g),有关下列图像的说法正确的是 ( )
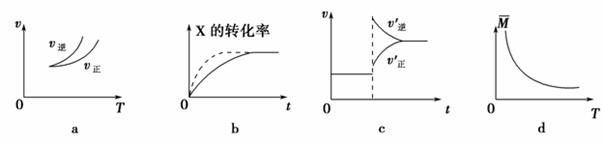
A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
如右图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
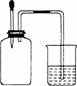
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
查看答案和解析>>
科目: 来源: 题型:
Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中都有气体放出。下列说法正确的是( )
A.都属于氧化还原反应
B.CaH2与水发生氧化还原反应产生H2,H2只是氧化产物
C.Na2O2、CaH2与水反应时水作氧化剂
D.CaC2、Mg3N2与水的反应属于复分解反应
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:K+、Ba2+、Cl-、HCO
C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO 、CH3COO-
、CH3COO-
D.pH=1的溶液中:Na+、NO 、S2-、Cl-
、S2-、Cl-
查看答案和解析>>
科目: 来源: 题型:
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
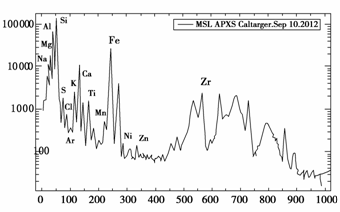
理解此图,判断下列说法错误的是( )
A.峰值最高的元素在地壳中的含量占第二位
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为Na+
C .氯比硫的非金属性强的依据之一是HClO4的酸性比H2SO4强
D.工业上常用电解氧化铝的方法制备铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com