
科目: 来源: 题型:
下列实验能达到预期目的的是 ( )
A.将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2
B.称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/LSnCl2溶液
C.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
D.测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.镁、铝具有一定的抗腐蚀性,是因为镁、铝不易被氧化
C.84消毒液的主要成分是NaClO
D.某些金属元素的焰色反应、海水提溴、煤的液化、石油的裂化都是化学变化的过程
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.100mL 2 mol·L-1碳酸钠溶液中,CO32-离子数为0.2NA
B.将10mL 1mol·L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA
C.1 mol Na2O2固体中含离子总数为3NA
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.苯和乙烯都能使溴水退色,其褪色原理是相同的
B.所有烷烃和蛋白质分子中都存在碳碳单键
C.人们通常用聚乙烯、聚氯乙烯塑料来制食品包装袋,它们都是高分子化合物
D.乙醇可以转化成乙酸,乙醇和乙酸都能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
高分子化合物G是作为锂电池中 Li+ 迁移的介质,合成G的流程如下:

已知:①
②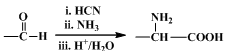
(1)D的官能团名称是 。
(2)A→B的反应类型是 。
(3)C的结构简式是 。
(4)D→E反应条件是 。
(5)G的结构简式是 。
(6)已知:

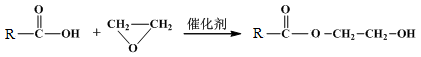
M→N的化学方程式是 。
(7)D的同分异构体中,写出有顺反异构的结构简式
注意:①两个羟基连在同一个碳上,羟基连在双键的碳上的结构不稳定都不予考虑。
②不考虑过氧键和环状结构 ③顺反结构均写出
查看答案和解析>>
科目: 来源: 题型:
水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图1是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
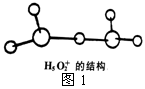
在该离子中,存在的作用力有______________。
a.配位键 b.极性键 c.非极性键 d.离子键
e.金属键 f.氢键 g.范德华力 h.π键 i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图2为冰的一种骨架形式,依此为单位向空间延伸。
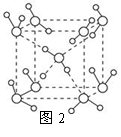
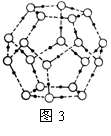
①该冰中的每个水分子有_________个氢键;
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。右图的五角十二面体是冰熔化形成的理想多面体结构。假设图3中的冰熔化后的液态水全部形成右图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3。(已知2952=8.70×104,2953=2.57×107,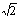 =1.41,
=1.41,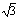 =1.73)
=1.73)
查看答案和解析>>
科目: 来源: 题型:
襄阳五中某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设] 假设1:气体产物只有SO2; 假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
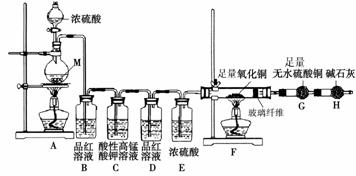
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式: ;
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。试写出烧瓶里发生反应的总化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
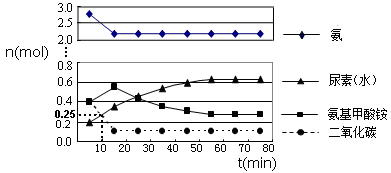
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变 B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变 D.单位时间有n个H-O键断裂的同时有n个H-H键断裂
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
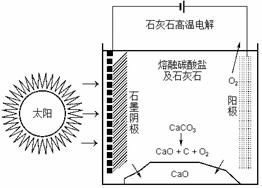
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
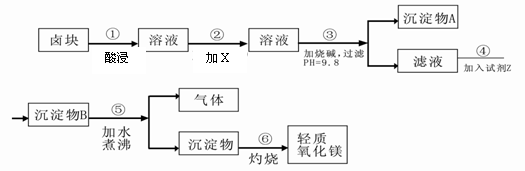
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH 表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
|
查看答案和解析>>
科目: 来源: 题型:
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
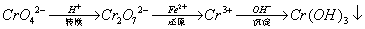
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
B.溶液颜色保持不变,说明上述可逆反应达到达平衡状态
C.常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com