
科目: 来源: 题型:
下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯
C.用溴水溶液鉴别苯、苯酚溶液、溴乙烷、乙醇和NaI溶液五种液体
D.用新制CaO检验乙醇中是否含有水分
查看答案和解析>>
科目: 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ② | ||||||||||||||||
| ③ | ④ | ⑤ | |||||||||||||||
| ⑦ | ⑥ |
请回答下列问题:
(1) ①和⑤形成的一种常见溶剂的电子式为
(2) 元素⑦的基态原子的简化电子排布式为
(3) ②的氢化物与⑤的氢化物比较,沸点②的更高,热稳定性②的也更强。请分别说明理由: ;
 (4) 右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物的沸点变化,则④的氢化物所在的折线是 (填m、n、x或y)。
(4) 右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物的沸点变化,则④的氢化物所在的折线是 (填m、n、x或y)。
(5)③与⑤构成的晶体晶胞如下图所示。已知晶体的密度为r g / cm3,阿伏加德罗常数为NA,则在晶体里距离最近的离子③与⑤的间距大约是 cm. (列出算式即可,不必化简)

(6)元素⑥的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若元素⑥ 的原子半径为r cm,NA代表阿伏加德罗常数,则该晶体的密度可表示为
g / cm3。(列出算式即可,不必化简)
查看答案和解析>>
科目: 来源: 题型:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
 (1)该实验应选用 作指示剂;
(1)该实验应选用 作指示剂;
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL;
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C(CH3COOH)= mo1/L。
查看答案和解析>>
科目: 来源: 题型:
医学上在进行胃肠疾病检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由(从物质性质方面):________________________ 。
Ⅱ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入下列溶液中溶解至饱和:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,
(1) 以上各溶液中,c(Ba2+)的大小顺序正确的是 (选填序号,下同),BaSO4的溶解度大小顺序是
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2) 已知25℃时,Ksp(BaSO4)=1.1×10-10,上述溶液③中的c(SO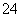 )为__________ mo1/L;
)为__________ mo1/L;
(3) 若将溶液③和溶液④直接混合,则混合溶液的pH为__________(假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目: 来源: 题型:
如下图所示,电极2、4、6均为石墨电极。通电一段时间后,电极5质量增加2.16 g,请回答:

(1)电源b是_______极;A池中反应的离子方程式为:
(2)电极6的电极反应式:
(3)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为 mo1/L。
查看答案和解析>>
科目: 来源: 题型:
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布图为 ;
(2)把HCl气体、NaCl固体、蔗糖分别溶于水,其中化学键发生变化的是 ;
(3)常温下把HCl气体溶于水制得0.1mol/L盐酸,该溶液中由水电离出的氢离子浓度为
mol/L;
(4)常温下把FeCl3固体溶于水,溶液的pH 7(填“大于”“小于”或“等于”),用离子方程式解释原因: ;把该溶液蒸干并灼烧,所得物质的化学式为 ;
(5)水既有氧化性又有还原性,请写出一个表现水的氧化性的化学方程式:
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,此配合离子的化学式是 ;向该蓝色溶液中加入少量氨水,现象为 ,继续加入过量氨水会产生 现象,原因
是 (用化学方程式或离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
已知2H2(g)+O2(g)===2H2O(l);ΔH=-569.6 kJ·mol-1,
2H2O(g)===2H2(g)+O2(g);ΔH=+482.1 kJ·mol-1。
则1 g液态H2O蒸发时吸收的热量是( )
A.2.43 kJ B.4.86 kJ C.43.8 kJ D.87.5 kJ
查看答案和解析>>
科目: 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g);ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
2C(g);ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2∶1∶2时,反应即达到平衡状态
B.4 s内用物质B表示的反应速率为0.075 mol/(L·s)
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
常温下,浓度均为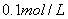 的三种溶液:①
的三种溶液:①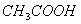 溶液、②
溶液、② 溶液、③
溶液、③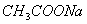 溶液。下列说法不正确的是 ( )
溶液。下列说法不正确的是 ( )
A.溶液的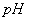 :②>③>①
:②>③>①
B.水电离出的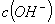 :③>①>②
:③>①>②
C.②和③等体积混合后的溶液: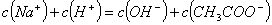
D. ①和②等体积混合后的溶液: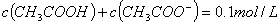
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com