
科目: 来源: 题型:
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -a kJ/mol
②CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H= -b kJ/mol
③H2O (g)= H2O(l) △H= -c kJ/mol
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)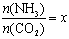 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。

下例说法正确的是
(A)NH3的平衡转化率随着x增大而增大,上图中的B点处,NH3的平衡转化率为32%
(B)上图中的D点处,未达到平衡状态,且v(正) < v(逆)
(C)当反应体系中H2O的质量不再改变时,反应达到平衡状态
(3)关于电化学的研究:
Na2FeO4和Zn可以组成碱性电池,其反应的离子方程式为:
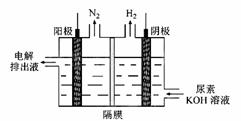
2FeO42- + 3Zn + 8H2O = 3Zn(OH)2+ 2Fe (OH)3+4 OH-,请写出放电时正极的电极反应式 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。当高铁电池中有3.32g Na2FeO4放电时,电解尿素[CO(NH2)2]的碱性溶液的阴阳两极共收集的气体体积为 mL(标准状况下)。
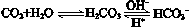 (4)关于电离平衡的研究:
(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
①正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射 缓解(填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(A-)>c(H+)
C.将等浓度的K2S和KHSO4两种溶液等体积,则混合溶液中离子浓度的大小关系为:c(K+)>c(SO42-)>c(HS-)>c(OH-)>c(H+)>c(S2-)
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍
(已知:Ksp(Cd(OH)2)=7.2×10-15,Ksp(Co(OH)2)=1.8×10-15)
查看答案和解析>>
科目: 来源: 题型:
已知:
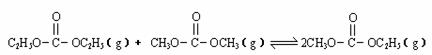
是碳酸甲乙酯的工业生产原理。右图是
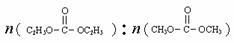
投料比分别为3︰1和1︰1,
当反应物的总物质的量相同时,
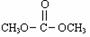 的平衡转化率与温度的关系曲线如右图所示。
的平衡转化率与温度的关系曲线如右图所示。
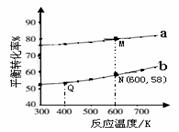
下列说法正确的是
A.曲线b所对应的投料比为3︰1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2︰1
查看答案和解析>>
科目: 来源: 题型:
有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
|
| 图Ⅰ碱性 锌锰电池 | 图Ⅱ铅硫 酸蓄电池 | 图Ⅲ铝箔的腐蚀 | 图Ⅳ银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂,负极反应为:Zn-2e-=Zn2+
B.图Ⅱ所示电池充电过程中,硫酸浓度不断增大,阴极反应为:
Pb+SO42-= PbSO4-2e-
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-===Cl2↑
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目: 来源: 题型:
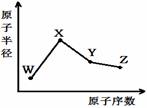
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
A.对应简单离子半径:X>W>Y>Z
B.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
C.X、W两元素形成的二元化合物中一定含有离子键
D.对应气态氢化物的稳定性W>Y,对应气态氢化物的熔沸点Y>W
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.在FeI2溶液中滴入几滴稀溴水:Fe2+ + Br2 = 2Fe3+ + 2Br-
B. FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2- ═2Fe2++S↓
C.在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3- + OH- = SO32- + H2O
D.等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
查看答案和解析>>
科目: 来源: 题型:
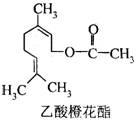
乙酸橙花酯是一种食用香料,其结构简式如下图所示,
关于该有机物的下列叙述中正确的是
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1 mol该有机物水解时只能消耗1 mol NaOH。
⑥1 mol该有机物在一定条件下和H2反应,共消耗H2 为3 mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A.汽油可由石油分馏和石油的催化裂化获得,可用作燃料
B.利用化学方法,我们可以制造出新的分子,但不能制造出新原子
C.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子
D.蔗糖及其水解产物中,只有一种物质能与新制氢氧化铜反应生成砖红色沉淀
查看答案和解析>>
科目: 来源: 题型:
本题共2个小题,请按要求作答。
(1)(10分)根据下列各组物质,回答问题(均填选项号):
A.O2与O3 B. 12C与13C C .正丁烷和异丁烷
.正丁烷和异丁烷
 |
 E
E .甲烷和庚烷 F.D与T
.甲烷和庚烷 F.D与T
G.金刚石与“足球烯”C60 H.16O、17O和18O
①互为同位素的是 ; ②互为同素异形体的是 ;
③属于同系物的是  ; ④互为同分异构体的是 ;
; ④互为同分异构体的是 ;
⑤属于同一物质的是 。
(2)(5分)用Cl2生产某些含氯有机物时会产生副产物HCl。利用下列反应,可实现氯的循环利用。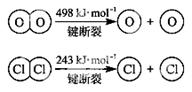
反应:4HCl+O2 = 2Cl2+2H2O
已知:该反应中, 4mol HCl被氧化,放出115.6 kJ的热量。
①H2O的电子式为__________。
②该反应中反应物的总能量_____________ 生成物的总能量。(填“大于、小于或等于”)
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的+1价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。反应(II)是海水提溴过程中涉及的重要反应。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
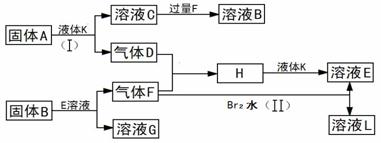
试回答:
(1)甲元素的名称为 ,溴元素在周期表的位置 ,丁元素的阴离子结构示意图为 。
(2)A的电子式为 ,所含化学键类型为 。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示) 。
(4)反应(I)的化学方程式为 。
(5)反应(II)的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com