
科目: 来源: 题型:
重水( 21D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目: 来源: 题型:
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程
上,其首要原因是 ( )
A.利用电池外壳的金属材料 B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
科目: 来源: 题型:
关于原子结构的叙述正确的是 ( )
A.所有的原子核都是由质子和中子组成的
B.原子的最外层电子数不超过8个(除K层)
C.稀有气体原子的最外层电子数均为8
D.M层最多容纳的电子数为32个
查看答案和解析>>
科目: 来源: 题型:
元素性质呈周期性变化的决定因素是 ( )
A.元素原子半径大小呈周期性变化
B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的主要化合价呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
对于反应H2 + Cl2 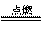 2HCl,下列说法正确的是:( )
2HCl,下列说法正确的是:( )
A.该反应中,化学能只有转变为热能
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出的能量
D.产物所具有的总能量高于反应物所具有的总能量
查看答案和解析>>
科目: 来源: 题型:
下列有关元素周期表中元素性质的叙述中正确的是( )
A. 同主族元素从上到下,非金属性逐渐增强
B. 元素的最高正化合价均等于它所在的族序数
C. 同周期的主族元素的原子半径越小,越难失去电子
D. 第ⅤA族元素的氢化物的沸点,从上到下依次逐渐升高
查看答案和解析>>
科目: 来源: 题型:
(1)若5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ。该反应的热化学方程式为 ;
乙炔的燃烧热为 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
__________________________________________________________________________。
(3)已知:
2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:
__________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如
下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1) 在2 min末时,B的平衡浓度为____________,A的平均反应速率为_____________。
(2) 若温度不变,缩小容器容积,则平衡__________________ (填“向正反应方向移动”、“ 向逆反应方向移动”或“不移动”)。
(3) 能判断该反应是否达到化学平衡状态的依据是____________
A.容器中压强不变
B.混合气体中c(C)不变
C.υ生成(D)=υ消耗(D)
D.2c(B)=c(C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com