
科目: 来源: 题型:
X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3.回答下列问题:
(1)Y简单阴离子的离子结构示意图为 。
(2)写出含有10个中子X原子的原子符号 。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应.写出该步反应的化学方程式 。
(4)用惰性电极电解由Y、W两种元素组成的化合物的溶液,写出阳极电极反应式 。
(5)Y的气态氢化物与氨气反应的生成物溶于水,其溶液中各离子浓度大小关系 。
查看答案和解析>>
科目: 来源: 题型:
现有A~H 8种短周期元素,它们在元素周期表中的位置如下.请据此回答下列问题:

(1)下列中的元素的原子间反应最容易形成离子键的是________
A.C和F B.B和G C.D和G D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是_ _ ___。
A.EA3 B.AG C.FG5 D.DG4
(3)由A、E组成的一种化合物化学式为EA5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式________。
(4)均由A、B、H和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种相对分子质量为120,该化合物溶于水时破坏的是___ ___(填化学键类型).
查看答案和解析>>
科目: 来源: 题型:
(1)有下列八种物质:①MgCl2晶体 ②干冰 ③NaOH晶体 ④白磷(P4)晶体 ⑤金刚石 ⑥硼晶体,其中属于离子晶体的是 ;属于分子晶体的是 ,属于原子晶体的是___ _。
(2)SO2的分子构型为 ,请从分子构型的角度分析SO2、CO2在水中溶解度的差别
查看答案和解析>>
科目: 来源: 题型:
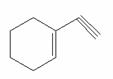
(1)某有机化合物分子结构式如右图采取sp2杂化的C原子有 个。
(2)试比较含氧酸酸性的强弱(填”>”,”<”或”=”)HClO4 HClO3
(3)沸点比较(填”>”,”<”或”=”):邻羟基苯甲醛 对羟基苯甲醛
(4)晶格能比较(填”>”,”<”或”=”):CaO KF
查看答案和解析>>
科目: 来源: 题型:
x、y、z、w是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊,是由其中的两种或三种元素组成的化合物。己是由z元素形成的单质。已知,甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)下列说法正确的是
A.1mol甲与足量的乙完全反应共转移1mol电子
B.y元素在周期表位置为第三周期IVA族
C.原子半径w大于z大于y大于x
D.1.0L 0.1mol·L-1戊溶液中阴离子总物质的量小于0.1mol
查看答案和解析>>
科目: 来源: 题型:
.0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量AgNO3处理,产生0.02 mol AgCl沉淀,此氯化铬在溶液中的存在形式最可能为
A.[Cr(H2O)6] Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
查看答案和解析>>
科目: 来源: 题型:
硫的卤化物(S2X2)是广泛用于橡胶工业的硫化剂,S2C12分子结构与H2O2相似。遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
A.稳定性S2C12>S2Br2
B.反应中,生成1molSO2,转移电子为3mol
C.分子中同时含有极性键和非极性键且各原子都满足8电子稳定结构
D.因为S-Cl键能比S-Br键能大,S2C12沸点比S2Br2高
查看答案和解析>>
科目: 来源: 题型:
三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
A.PCl3分子中三个共价键的键长,键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能均相等
D.PCl3是非极性分子
查看答案和解析>>
科目: 来源: 题型:
已知C3N4晶体的硬度很可能比金刚石还大,且原子间均以单键结合,下列关于C3N4的说法正确的是
A.C3N4可能是分子晶体
B.C3N4晶体中C—N键的键长比金刚石的C—C键的键长要长
C.C3N4晶体是每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以非极性键形成空间的网状结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com