
科目: 来源: 题型:
我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质。

结合上述工艺流程回答下列问题。
(1)物质H和L的化学式分别为 和 。
(2)上述工艺流程中可以循环使用的物质的化学式为____________。
(3)反应①的化学方程式为 ;在反应①中必须先通入NH3,而后通入D,其原因是 。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为 。
(5)由K溶液经如何处理才能制得N?工业上将K溶液在 的条件蒸发结晶制得无水盐,然后再电解其熔融盐,写出电解的化学反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的单质在一定条件下能与X元素的单质反应
C.Z元素的离子半径大于W元素的离子半径
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
查看答案和解析>>
科目: 来源: 题型:
下列说法中错误的是
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.SO3为平面正三角形结构
C.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
D.配位数为4的配合物均为正四面体结构
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中
C(CH3COO--)/C(CH3COOH) C(OH--)的值减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH )/c(NH3·H2O)的值增大
)/c(NH3·H2O)的值增大
查看答案和解析>>
科目: 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
A.每生成1 mol Na2Mn5O10转移2 mol电子 B.正极反应式:Ag+Cl--e-=AgCl
C.Na+不断向“水”电池的负极移动 D.AgCl是还原产物
查看答案和解析>>
科目: 来源: 题型:
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.装置中发生反应的离子方程式为:2Cl-+2H+Cl2↑+H2↑
C.该装置是将电能转化为化学能
D.该离子交换膜只能让阳离子通过,不能让阴离子通过
查看答案和解析>>
科目: 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
B.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
下列溶液中离子浓度的关系一定正确的是
A. 和
和 溶液中:
溶液中: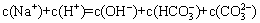
B.一元弱碱MOH对应的盐MCl溶液中: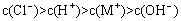
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com