
科目: 来源: 题型:
A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
查看答案和解析>>
科目: 来源: 题型:
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为16,则该反应的还原产物是
A.NO B.NO2 C.N2O D.NH4NO3
查看答案和解析>>
科目: 来源: 题型:
香草醛愈创木酚作原料合成,合成路线如下图所示。香草醛的合成路线。下列说法正确的是
A.理论上反应1→2中原子利用率100%
B.化合物2在一定条件下可发生加聚反应
C.检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D.等物质的量的四物质与足量NaOH溶液反应,消耗NaOH物质的量比为1324
查看答案和解析>>
科目: 来源: 题型:
常温时,下列说法正确的是
A.pH=5的NH4Cl溶液中,由水电离出的c(H+)为10-9 mol/L
B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.在c(H+)c(OH-)=11012的溶液中,Na+、I-、NO3-、SO32-能大量共存
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中
c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.在纯水中加入醋酸会促进水的电离 B.1 mL pH = 2的醋酸稀释至10 mL,pH=3
C.常温下,0.1 mol·L –1氯化铵溶液加水稀释,溶液中所有离子浓度均减小
D.加热Na2CO3溶液能提高其除油污的能力
查看答案和解析>>
科目: 来源: 题型:
下列图示与对应的叙述不相符的是
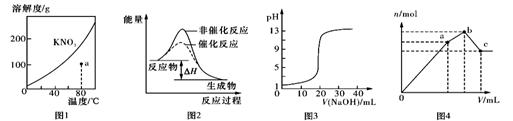
A.图1表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线
D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化
查看答案和解析>>
科目: 来源: 题型:
下列有关金属腐蚀与防护的说法正确的是
A.金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生
B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈
C.钢铁发生析氢腐蚀时,正极发生的电极反应为:Fe-2e-®Fe2+
D.埋在地下的钢管与电正极连接可以减缓腐蚀
查看答案和解析>>
科目: 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
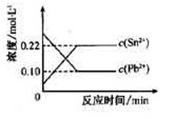 Sn(s)+Pb2+(aq)
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.25℃时,该反应的平衡常数K=2.2
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目: 来源: 题型:
恒温恒容的三个密闭容器,N2(g)+3H2(g)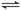 2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
A.放出热量a<b<92.4 B.三个容器内反应的平衡常数③>①>②
C.N2的转化率①<② D.达平衡时氨气的体积分数①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com