
科目: 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Na与乙醇完全反应,失去2nA电子 B.常温常压下,10gCH4含有10nA个电子
C.1L 0.1mol•L-1的醋酸溶液中含有0.1nA个H+ D.标准状况下,22.4L苯含有nA个苯分子
查看答案和解析>>
科目: 来源: 题型:
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:
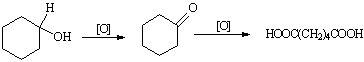
实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。


(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
利用反应:Cu2Cl2 +C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 ▲ 。
(2)NH3中氮原子的杂化方式为 ▲ ;NH4+空间构型为 ▲ (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ▲ ,与C22-互为等电子体的分子有 ▲ (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 ▲ 。

(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 ▲ (写化学式)。
查看答案和解析>>
科目: 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程
▲ 。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 ▲ 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ ▲ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: ▲ 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 ▲ 。

(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = ▲ kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,
最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式
Ksp= ▲ 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 ▲ 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 ▲
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一
▲ 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 ▲ 。
(6)电解熔融的MgCl2,阳极的电极反应式为: ▲ ;阴极的电极反应式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com