
科目: 来源:0101 期中题 题型:实验题
查看答案和解析>>
科目: 来源:0103 月考题 题型:实验题
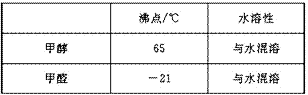

查看答案和解析>>
科目: 来源:0102 月考题 题型:实验题




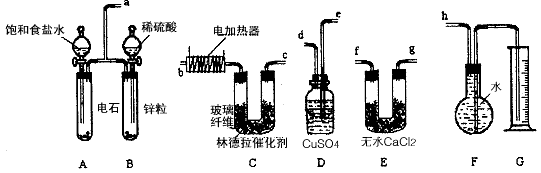
 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。  ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示: 
查看答案和解析>>
科目: 来源:专项题 题型:实验题
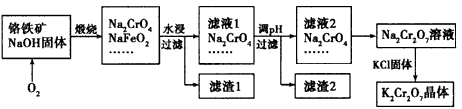
 2CrO42- +2H+。
2CrO42- +2H+。查看答案和解析>>
科目: 来源:专项题 题型:单选题
 CO
CO CO2
CO2 Na2CO3
Na2CO3 Cu(NO3)2溶液
Cu(NO3)2溶液 Cu(OH)2
Cu(OH)2 Ca(OH)2溶液
Ca(OH)2溶液 NaOH溶液
NaOH溶液 Fe2O3
Fe2O3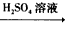 Fe2(SO4)3溶液
Fe2(SO4)3溶液 查看答案和解析>>
科目: 来源:同步题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:江苏高考真题 题型:实验题

查看答案和解析>>
科目: 来源:同步题 题型:填空题
 R-Br+H2O
R-Br+H2O 
查看答案和解析>>
科目: 来源:江苏高考真题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com