
科目: 来源:0113 会考题 题型:实验题

查看答案和解析>>
科目: 来源:模拟题 题型:实验题
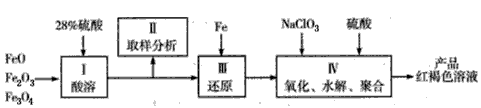
查看答案和解析>>
科目: 来源:模拟题 题型:实验题

查看答案和解析>>
科目: 来源:模拟题 题型:填空题

 )做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和水时,加入试剂的顺序应是________________ ,加好试剂后,为了让它们充分反应,不能用
)做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和水时,加入试剂的顺序应是________________ ,加好试剂后,为了让它们充分反应,不能用查看答案和解析>>
科目: 来源:模拟题 题型:实验题
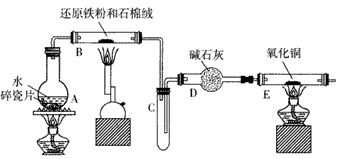

查看答案和解析>>
科目: 来源:山东省高考真题 题型:实验题
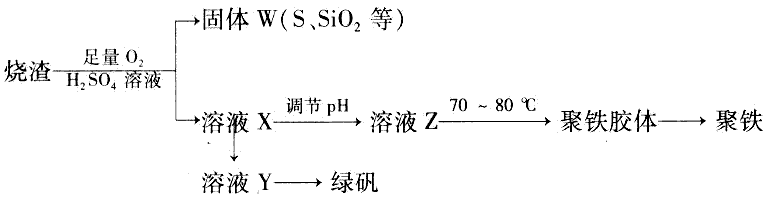

查看答案和解析>>
科目: 来源:月考题 题型:计算题

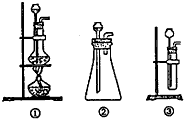

查看答案和解析>>
科目: 来源:0127 模拟题 题型:实验题

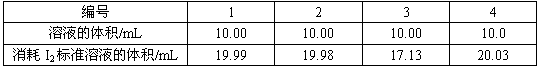
查看答案和解析>>
科目: 来源:安徽省模拟题 题型:实验题

查看答案和解析>>
科目: 来源:专项题 题型:实验题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com