
科目: 来源:模拟题 题型:实验题
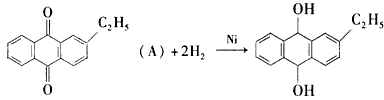
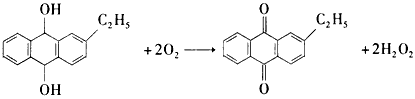
查看答案和解析>>
科目: 来源:模拟题 题型:实验题

查看答案和解析>>
科目: 来源:海南省高考真题 题型:实验题
查看答案和解析>>
科目: 来源:模拟题 题型:实验题
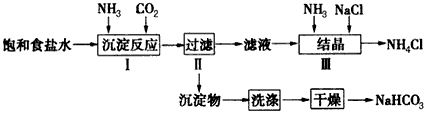

试简述将浓氨水滴入锥形瓶中的操作:_________________。
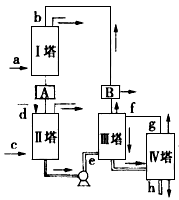
(2)若用图2装置进行该沉淀反应,反应方程式为:NaCl +NH3+CO2+H2O=NaHCO3↓+NH4Cl。实验时,须先从______(填“a”、“b”或“c”)口通入__________。
(3)步骤Ⅲ向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①已知四种相关物质不同温度下的溶解度曲线如图3所示,则结晶时宜采用________(填“蒸发结晶” 或“降温结晶”)。
②某同学设计了如图4所示的装置来验证所得的晶体中含有NH4+。
具体操作:取少量晶体于硬质试管中,对晶体部位加热。并在____(填“A”或“B”)处放置____ 试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等。
①准确称量ag样品溶于水,加入足量沉淀剂。沉淀剂最好选用____。
A.Ca(OH)2溶液 B.CaCl2溶液 C.BaCl2溶液 D.Ba(OH)2溶液
②过滤、洗涤、烘干,冷却、称量,称得固体质量为bg。
③重复以上“烘干,冷却、称量”操作,直至____ 为止。此时称得固体质量为cg。
④计算:样品中NaHCO3的含量为____。
查看答案和解析>>
科目: 来源:模拟题 题型:实验题


查看答案和解析>>
科目: 来源:模拟题 题型:实验题
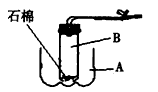
查看答案和解析>>
科目: 来源:同步题 题型:实验题
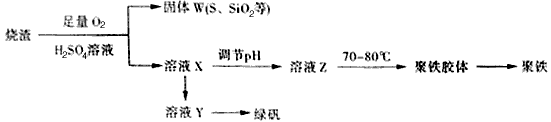
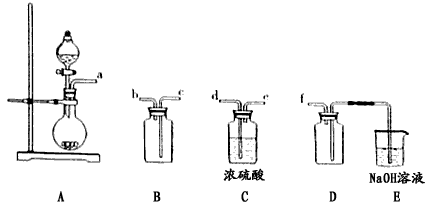
查看答案和解析>>
科目: 来源:0110 同步题 题型:实验题
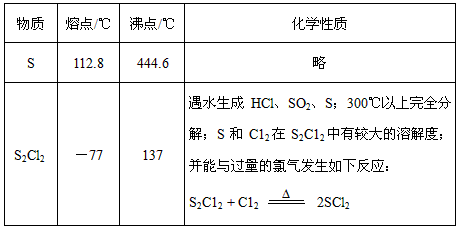
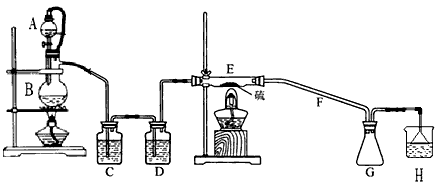
查看答案和解析>>
科目: 来源:同步题 题型:实验题
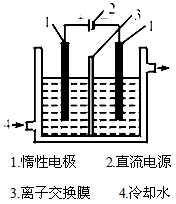
(1)碘是_______(填颜色)固体物质,实验室常用___________方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液中,溶解时发生反应:3I2+6KOH====5KI+KIO3
+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为_______________;阴极上观察到的实验现象是_____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
查看答案和解析>>
科目: 来源:同步题 题型:推断题
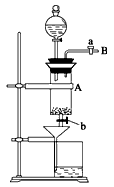
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com